-
科室:
眼底病科
-
别名:
复发性中心性视网膜炎
特发性中心性浆液性脉络膜炎
-
症状:
视觉减退
-
发病部位:
暂无
-
多发人群:
成年人多见
-
相关疾病:
视网膜病变
中心性浆液性脉络膜视网膜病变(central serous chorioretinopathy,CSC)是以黄斑部及其附近局限性浆液性神经上皮脱离为特征的常见眼底病变,国内临床上常简称“中浆”。1866年Von Graefe首先描述了该病,并命名为“复发性中心性视网膜炎”。此后整整一个世纪中,人们对其认识越来越深入,但对病因与病机始终不能明了。直到1965年,Maumenee通过荧光造影观察到该病变是由色素上皮渗漏引起的。1967年Gass详细描述了该病的病理和临床特征,对其神经上皮层盘状脱离的机制做了详尽的论述,并将其命名为“特发性中心性浆液性脉络膜炎”(idiopathic central serous choroidopathy)。考虑到该病同时累及了脉络膜和视网膜,后来逐渐将名称统一为“中心性浆液性脉络膜视网膜炎”。近年来,吲哚青绿血管造影的出现,为进一步研究CSC提供了新的方法,也对其发病机制有了新的认识。[收起]
中心性浆液性脉络膜视网膜病变(central serous chorioretinopathy,CSC)是以黄斑部及其附近局限性浆液性神经上皮脱离为特征的常见眼底病变,国内临床上常简称“中浆”。1866年Von Graefe首先描述了该病,并命名为“复发性中心性视网膜炎”。此后整整一个世纪中,人们对其认识越来越深入,但对病因与病机始终不能明了。直到1965年,Maumenee通过荧光造影观察到该病变是由色素上皮渗漏引起的。1967年Gass详细描述了该病的病理和临床特征,对其神经上皮层盘状脱离的机制做了详尽的论述,并将其命名为“特发性中心性浆液性脉络膜炎”(idiopathic central...[详细]
中浆(CSC)可能是多因素作用的结果,其发病与年龄、性别、血型、气候、全身情况、妊娠、精神紧张、情绪异常、过敏、感冒、感染、过度疲劳和烟酒刺激等均有关。常见诱因有睡眠不足、紧张、劳累、情绪波动等。A型性格者易发生中浆,可能与交感神经兴奋,血循环中儿茶酚胺升高有关。实验性肾上腺素黄斑病变和无晶体眼性肾上腺素黄斑病变表现与中浆类似。临床上中浆好发于年轻男性和更年期女性,以及一些库欣病变和妊娠者,这些都说明内源性或外源性皮质激素失衡可能是中浆的一个致病原因。
中浆的发病机制尚不十分清楚,有缺血、感染、炎症、免疫反应及代谢障碍等学说,但都缺乏有力证据。荧光造影显示中浆主要是RPE细胞失代偿,表现为RPE细胞连续性中断,出现染料渗漏,这是RPE连接复合体即屏障功能被破坏的结果,并不是RPE细胞坏死。这可能仅仅是病变的病理损害之一,尚不是疾病的原因。由于RPE细胞屏障功能破坏和输送离子功能出现异常,造成视网膜下积液,形成黄斑区盘状视网膜脱离。近年来临床应用ICG眼底血管造影发现中浆不仅有RPE渗漏性改变,更主要是相应区域的脉络膜毛细血管迟缓充盈或高灌注,通透性增强,推测该病可能是由于某些因素导致脉络膜血管痉挛或闭塞,引起脉络膜血管的灌注异常,周围脉络膜血管代偿性扩张,通透性增高,导致视网膜色素上皮屏障功能受损,液体积聚于视网膜色素上皮和神经上皮之间。实验性阻塞脉络膜毛细血管小叶,可以诱导出局限性浆液性视网膜脱离,与中浆有类似之处。一些激光后治愈或自行恢复的患者ICGA结果显示尽管RPE无渗漏点存在,但脉络膜小叶仍存在高灌注和高通透性现象。这种现象与复发是否有关,还有待进一步研究。由此推测,中浆的原发病理部位应位于脉络膜毛细血管,RPE改变是继发性的。[收起]
中浆的发病机制尚不十分清楚,有缺血、感染、炎症、免疫反应及代谢障碍等学说,但都缺乏有力证据。荧光造影显示中浆主要是RPE细胞失代偿,表现为RPE细胞连续性中断,出现染料渗漏,这是RPE连接复合体即屏障功能被破坏的结果,并不是RPE细胞坏死。这可能仅仅是病变的病理损害之一,尚不是疾病的原因。由于RPE细胞屏障功能破坏和输送离子功能出现异常,造成视网膜下积液,形成黄斑区盘状视网膜脱离。近年来临床应用ICG眼底血管造影发现中浆不仅有RPE渗漏性改变,更主要是相应区域的脉络膜毛细血管迟缓充盈或高灌注,通透性增强,推测该病可能是由于某些因素导致脉络膜血管痉挛或闭塞,引起脉络膜血管的灌注异常,周围脉络膜血...[详细]
多为健康成年人,骤然发觉视物模糊,视野中心似有淡影阻挡,视物可有变形、变小的感觉。视力障碍程度不一,远视力检查从1.0到0.1。用Amsler方格表检查常有变形或暗点。 眼底检查在病变轻者仅见后极部视网膜呈闪烁不定的反光,中心凹光反射略为弥散。重者可见黄斑区视网膜有圆形隆起的盘状脱离,其边缘有反光轮。数周后盘状脱离区有黄白色渗出点。裂隙灯接触镜检查,从光学切面显示神经上皮层与色素上皮层分离,神经层向前隆起,脱离腔的后壁有黄白色点状物,腔内积液可透明或略现混浊。个别极重病例,视网膜下液体过多,因重力作用而向下方流动,使周边视网膜脱离。液体吸收后,常在眼底下半留下液体流经区域的色素上皮萎缩条带,清楚地显示当初视网膜下液体通道的痕迹与范围。 对于复发病例或在隐匿进行的患者,检眼镜下所见,除严重渗液者可再现盘状脱离外,大多数只表现黄斑区色素紊乱,或中心凹反射异常。仅从眼底表现不能判定是否病情复发或是隐匿进行。并且患者视力好坏也常与病变进展并不平行。对于疑为慢性进行病变的患眼应当再行荧光血管造影检查,因为造影图像所见与眼底表现有很大的不同。造影图片可以具体显示色素上皮的损害程度和病变范围,了解病情究竟是复发活跃还是萎缩稳定。 本病虽有较大程度的自限性,经过垂直追踪观察发现有的病例可以延续多年,时显时隐,病变范围也逐渐扩大,色素上皮萎缩也严重。据统计约1/3或半数病眼可以复发,10%病例可多次复发,50%病例复发期在1年左右,而顽固病例可长达10年。少数病眼经多次发作后,最终可使中心视力蒙受永久性损害。[收起]
多为健康成年人,骤然发觉视物模糊,视野中心似有淡影阻挡,视物可有变形、变小的感觉。视力障碍程度不一,远视力检查从1.0到0.1。用Amsler方格表检查常有变形或暗点。 眼底检查在病变轻者仅见后极部视网膜呈闪烁不定的反光,中心凹光反射略为弥散。重者可见黄斑区视网膜有圆形隆起的盘状脱离,其边缘有反光轮。数周后盘状脱离区有黄白色渗出点。裂隙灯接触镜检查,从光学切面显示神经上皮层与色素上皮层分离,神经层向前隆起,脱离腔的后壁有黄白色点状物,腔内积液可透明或略现混浊。个别极重病例,视网膜下液体过多,因重力作用而向下方流动,使周边视网膜脱离。液体吸收后,常在眼底下半留下液体流经区域的色素上皮...[详细]
1.荧光素眼底血管造影 FFA是确诊中浆的必不可少的手段,也是激光治疗中浆的依据。其表现形式多样,归纳起来有以下几种表现: (1)渗漏点型:为CSC的典型表现。有3种渗漏点形态: ①圆点扩大型(又称墨渍弥散型):以染料渗漏的一点为中心向四周扩大,最常见,占70%~80%(图1)。 ②喷出型(又称冒烟型):呈冒烟状,是由于FFA后期染料进入脱离的视网膜下间隙内形成一盘状荧光池所致,占10%~20%(图2)。
②喷出型(又称冒烟型):呈冒烟状,是由于FFA后期染料进入脱离的视网膜下间隙内形成一盘状荧光池所致,占10%~20%(图2)。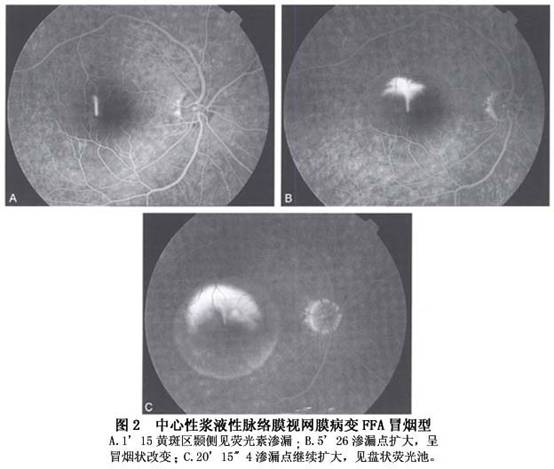 ③不典型渗漏点型:病变常呈丛状分布,呈外围亮中央黑的荧光染色点和(或)窗样缺损样或玻璃膜疣状荧光亮点,渗漏不明显或极缓慢,不伴盘状浆液性视网膜脱离,多见于慢性复发性、亚急性或恢复期病例。 同一眼内的渗漏点可以多个,以上3种类型的渗漏也可以同时存在,均在荧光造影静脉期后出现,仅极少数在动脉期出现,这是中浆与脉络膜新生血管膜的重要鉴别点之一,后者的渗漏时间在动脉早期。 (2)局限区RPE渗漏染色型:表现为局限性RPE强荧光染色,渗漏十分缓慢,相应区伴或不伴盘状浆液性视网膜脱离,常伴发广泛RPE失代偿和(或)RPE萎缩带。 (3)RPE浆液性脱离型:FFA早期即显荧光,并逐渐增强,造影后期呈界限清楚、形态大小不变、染色均匀的荧光池,有些病例可以在脱离的RPE上同时伴浆液性视网膜脱离,这种情况下FFA早期出现渗漏点,后期有盘状荧光。 (4)混合复杂型:除了有渗漏性病变[渗漏点和(或)RPE染色和(或)RPE脱离]外,还伴发RPE萎缩带和(或)下方周边部浆液性视网膜脱离。RPE萎缩带范围可以很广,由后极部向下方延伸,有时周边部眼底可有三角综合征的表现。 (5)正常荧光造影所见型:尽管较少见,但也确实存在。推测可能是RPE屏障功能尚未明显损害,不足以渗漏荧光素,但可以渗漏水分子,或是因为RPE渗漏十分缓慢,观察时间不够长,或已是恢复期,渗漏点已封闭,视网膜下液尚未完全吸收的缘故。 2.吲哚青绿荧光血管造影 1986年,Hayashi应用吲哚青绿荧光血管造影(ICGA)观察了5例CSC患者,首先提出中浆视网膜色素上皮功能的损害与脉络膜循环障碍有关。目前ICGA已成为研究CSC病理改变的重要方法,也是诊断该病的主要手段之一,尤其是对于临床表现不典型如老年患者或伴有不典型色素上皮萎缩的CSC患者。中浆的ICGA主要表现有: (1)脉络膜血管低灌注:ICGA早期可见到1处或多处脉络膜血管充盈延迟,呈形态不规则的暗区,直径1~1.5PD,持续10~15s后暗区逐渐消失。FFA于背景期在相应位置出现弱荧光区,迅速消失。 (2)脉络膜血管高渗透:在ICGA早期显示后极部1处或多处异常脉络膜强荧光,有些强荧光区与脉络膜低灌注区明显相关,紧邻于脉络膜低灌注区,或与低灌注区重合。部分强荧光区中可见扩张的脉络膜血管。FFA于相应部位出现点或片状强荧光,出现时间与ICGA一致,但病灶数量一般少于ICGA(图3)。
③不典型渗漏点型:病变常呈丛状分布,呈外围亮中央黑的荧光染色点和(或)窗样缺损样或玻璃膜疣状荧光亮点,渗漏不明显或极缓慢,不伴盘状浆液性视网膜脱离,多见于慢性复发性、亚急性或恢复期病例。 同一眼内的渗漏点可以多个,以上3种类型的渗漏也可以同时存在,均在荧光造影静脉期后出现,仅极少数在动脉期出现,这是中浆与脉络膜新生血管膜的重要鉴别点之一,后者的渗漏时间在动脉早期。 (2)局限区RPE渗漏染色型:表现为局限性RPE强荧光染色,渗漏十分缓慢,相应区伴或不伴盘状浆液性视网膜脱离,常伴发广泛RPE失代偿和(或)RPE萎缩带。 (3)RPE浆液性脱离型:FFA早期即显荧光,并逐渐增强,造影后期呈界限清楚、形态大小不变、染色均匀的荧光池,有些病例可以在脱离的RPE上同时伴浆液性视网膜脱离,这种情况下FFA早期出现渗漏点,后期有盘状荧光。 (4)混合复杂型:除了有渗漏性病变[渗漏点和(或)RPE染色和(或)RPE脱离]外,还伴发RPE萎缩带和(或)下方周边部浆液性视网膜脱离。RPE萎缩带范围可以很广,由后极部向下方延伸,有时周边部眼底可有三角综合征的表现。 (5)正常荧光造影所见型:尽管较少见,但也确实存在。推测可能是RPE屏障功能尚未明显损害,不足以渗漏荧光素,但可以渗漏水分子,或是因为RPE渗漏十分缓慢,观察时间不够长,或已是恢复期,渗漏点已封闭,视网膜下液尚未完全吸收的缘故。 2.吲哚青绿荧光血管造影 1986年,Hayashi应用吲哚青绿荧光血管造影(ICGA)观察了5例CSC患者,首先提出中浆视网膜色素上皮功能的损害与脉络膜循环障碍有关。目前ICGA已成为研究CSC病理改变的重要方法,也是诊断该病的主要手段之一,尤其是对于临床表现不典型如老年患者或伴有不典型色素上皮萎缩的CSC患者。中浆的ICGA主要表现有: (1)脉络膜血管低灌注:ICGA早期可见到1处或多处脉络膜血管充盈延迟,呈形态不规则的暗区,直径1~1.5PD,持续10~15s后暗区逐渐消失。FFA于背景期在相应位置出现弱荧光区,迅速消失。 (2)脉络膜血管高渗透:在ICGA早期显示后极部1处或多处异常脉络膜强荧光,有些强荧光区与脉络膜低灌注区明显相关,紧邻于脉络膜低灌注区,或与低灌注区重合。部分强荧光区中可见扩张的脉络膜血管。FFA于相应部位出现点或片状强荧光,出现时间与ICGA一致,但病灶数量一般少于ICGA(图3)。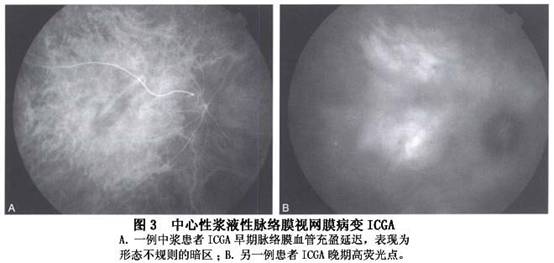 (3)荧光渗漏:ICGA晚期弱荧光区内出现孤立的强荧光点。 (4)RPE脱离:ICGA早期表现为强荧光,范围略大于FFA,晚期呈弱荧光表现。 (5)视网膜神经上皮脱离:ICGA晚期后极部呈现圆形或类圆形强荧光,形态规则,边缘光滑,直径2~4PD,与无赤光检查中“盘状脱离”的形态基本一致。 3.中心视野 急性期存在相对或绝对中心暗点,尤其是Amsler表检查暗点更明确,且有视物变形,恢复期后中心视野可以正常。但是对于病程长的病例,或反复多次发作病例,中心视野可能存在相对的暗点。有的病例视力恢复很好,但Amsler表检查中心相对暗点仍存在,视物变形更多见,对比敏感度、后像恢复时间等常不可能完全恢复。[收起]
1.荧光素眼底血管造影 FFA是确诊中浆的必不可少的手段,也是激光治疗中浆的依据。其表现形式多样,归纳起来有以下几种表现: (1)渗漏点型:为CSC的典型表现。有3种渗漏点形态: ①圆点扩大型(又称墨渍弥散型):以染料渗漏的一点为中心向四周扩大,最常见,占70%~80%(图1)。 ②喷出型(又称冒烟型):呈冒烟状,是由于FFA后期染料进入脱离的视网膜下间隙内形成一盘状荧光池所致,占10%~20%(图2)。 ③不典型渗漏点型:病变常呈丛状分布,呈外围亮中央黑的荧光染色点和(或)窗样缺损样或玻璃膜疣状荧光亮点,渗漏不明显或极缓慢,不伴盘状浆液性视网...[详细]
(3)荧光渗漏:ICGA晚期弱荧光区内出现孤立的强荧光点。 (4)RPE脱离:ICGA早期表现为强荧光,范围略大于FFA,晚期呈弱荧光表现。 (5)视网膜神经上皮脱离:ICGA晚期后极部呈现圆形或类圆形强荧光,形态规则,边缘光滑,直径2~4PD,与无赤光检查中“盘状脱离”的形态基本一致。 3.中心视野 急性期存在相对或绝对中心暗点,尤其是Amsler表检查暗点更明确,且有视物变形,恢复期后中心视野可以正常。但是对于病程长的病例,或反复多次发作病例,中心视野可能存在相对的暗点。有的病例视力恢复很好,但Amsler表检查中心相对暗点仍存在,视物变形更多见,对比敏感度、后像恢复时间等常不可能完全恢复。[收起]
1.荧光素眼底血管造影 FFA是确诊中浆的必不可少的手段,也是激光治疗中浆的依据。其表现形式多样,归纳起来有以下几种表现: (1)渗漏点型:为CSC的典型表现。有3种渗漏点形态: ①圆点扩大型(又称墨渍弥散型):以染料渗漏的一点为中心向四周扩大,最常见,占70%~80%(图1)。 ②喷出型(又称冒烟型):呈冒烟状,是由于FFA后期染料进入脱离的视网膜下间隙内形成一盘状荧光池所致,占10%~20%(图2)。 ③不典型渗漏点型:病变常呈丛状分布,呈外围亮中央黑的荧光染色点和(或)窗样缺损样或玻璃膜疣状荧光亮点,渗漏不明显或极缓慢,不伴盘状浆液性视网...[详细]
根据症状、临床表现以及荧光造影所见,对该病的诊断一般不难。
60%~80%的中浆患者不用任何治疗3个月内可自愈,10%~20%患者3~6个月内可自愈,自愈后中心视力可恢复正常。但有些患者反复多次发作,长年迁延不愈,形成广泛的色素上皮继发性改变,甚至出现黄斑下机化膜,导致视力大幅度减退甚至永久性丧失。目前关于中浆的治疗措施和时机,还都存在争议。主要的治疗方法有: 1.药物治疗 由于本病确切发病原因不明,目前缺乏针对性的有效药物治疗。大量临床实践证明,激素使用后可加重病情,可发生大泡性视网膜脱离,应避免使用。皮质激素致病变加重的机制不明,推测可能是激素使视网膜色素上皮细胞间的封闭小带松解所致,也可能激素作为免疫抑制剂抑制免疫反应,导致视网膜色素上皮细胞进一步损害和屏障功能破坏而引起。烟酸作为血管扩张剂应用于本病,有可能加重血管渗漏,引起黄斑水肿,延长病程,甚至引起大泡状视网膜脱离,也不宜使用。 应用乙酰唑胺治疗中心性浆液性视网膜病变可缩短主观视力改善时间和水肿消退时间,对最终视力无影响,也不影响疾病的复发率,但需注意药物的不良反应。其作用机制主要是通过视网膜下间隙酸化,减少静止电位,增加视网膜黏附性,有助于视网膜下液吸收;或通过抑制视网膜色素上皮的碳酸酐酶,重建视网膜色素上皮极性,促进液体转运吸收,也可能通过抑制眼组织中γ-谷氨酸转肽酶活性,促进细胞黏附、粒细胞趋化和细胞变性,以达到抗炎作用。 2.光凝治疗 光凝治疗是目前治疗中浆较有效、安全且并发症少的方法。可以缩短病程,有助于视力的恢复,但并不能减少或预防复发。 因中浆为一自限性疾病,故激光治疗应在3~6个月后进行。然而,临床上一些病例视力虽然恢复了正常,但对比敏感度、后像恢复时间等均不能完全恢复,更有甚者长期存在视物变形。有研究表明,黄斑长期浆液性视网膜脱离,感光细胞外节与RPE细胞微绒毛的正常定向性生理嵌合不能恢复正常,病程越长,这种嵌合越不完善。因此越来越多的学者主张,在条件许可的情况下,中浆应及时进行光凝治疗。 激光治疗中浆的机制在于利用激光热效应破坏失代偿的RPE细胞,刺激周围正常RPE细胞增殖,形成新的脱色素的RPE细胞和新的RPE屏障功能。这种激光效应只限于破坏RPE层,愈合期不应有增殖瘢痕形成,所以激光能量控制在I~Ⅱ级光斑反应为宜。 光凝的方法及注意点: (1)可选用绿、黄、橙红、红及半导体红外光。原则上黄斑部光凝不用蓝光。光斑大小100~300μm,曝光时间0.1~0.2s,输出功率0.1~0.4W,输出功率大小与使用的波长、视网膜脱离的程度及时间、视网膜下积液的成分有关。 (2)FFA显示有明显渗漏,渗漏点位于乳头黄斑束以外,离中心凹外250μm以上者,直接光凝渗漏点即可。而对于中心凹及无血管区的渗漏点,可以采用间接光凝法,即在盘状视网膜脱离边缘半周或1周光凝数点或数十点,分1~2排,这种方法较安全,虽不能减少渗漏,但能促进视网膜下液吸收,对缩短病程有一定的帮助。 (3)激光光凝后1周左右,神经上皮层浆液性脱离开始消退,残留的视网膜下液尚需数天乃至3~4周才能被逐渐吸收,因此视力并不立即恢复。 (4)激光输出功率应严格控制,若能量过大,会产生激光瘢痕,一旦在中心凹区域,术后易出现永久性中心暗点。 光凝治疗对大部分中浆有效、简单、安全,可缩短病程,促进视力恢复,改善症状,可作为中浆的首选治疗。 3.光动力疗法 一些慢性或持久性CSC,疾病后期易并发脉络膜新生血管膜(CNV),对于这部分患者,可考虑行光动力疗法。有人对10例CSC引起的CNV进行PDT治疗,采用6mg/m2的维替泊芬(vertepomn)静脉注射,用689nm的激光照射,光照剂量为50J/cm2,光斑大小以ICGA结果为指导。随访12.6个月后,6例视力提高2行以上,4例视力不变,无视力下降者。所有病例均观察到原本扩张的脉络膜毛细血管变小,渗漏减少,因此认为PDT对CSC引起的CNV是一种安全有效的方法。Mehryar Taban等也做了类似的研究,术后OCT结果显示渗漏停止,视网膜下液明显吸收,浆液性脱离逐渐好转。 4.手术治疗 绝大部分的CSC经过休息、适当的药物治疗或光凝得以痊愈,但并不是所有患者均能自愈,亦不是都适合光凝治疗。有些患者渗漏点位于中心凹,病程长,反复发作,迁延不愈,而长时间的神经上皮层脱离(视网膜脱离)必然会导致感光细胞凋亡,最终视功能受到严重损害,这些患者既往没有好的治疗方法。随着玻璃体视网膜手术的快速发展,其手术适应证不断扩大,并发症不断减少,特别是近几年微创手术的发展,使得以往许多手术禁区得以突破。有人曾对几例迁延不愈的CSC患者行玻璃体切割术,术后患者黄斑区视网膜下液吸收,视力提高,获得了较为满意的疗效。该手术的目的在于去除可能存在的玻璃体牵引,促进神经上皮复位,加速视网膜下液的吸收。步骤主要包括玻璃体次全切除、人工制造玻璃体后脱离、切除玻璃体后皮质,然后作视网膜神经上皮层微切口,用小号笛形针排出视网膜下液(也可以不排),术毕SF6或者C2F6气体眼内填充。为尽可能减少手术创伤,建议采用25G微创系统,以缩短手术时间,尽可能减少白内障、出血、感染、视网膜脱离等手术并发症的发生。同时要严格掌握手术适应证,如:①病程长达半年以上,迁延不愈;②大范围神经上皮脱离;③视力低于0.3;④不适合进行光凝;⑤充分理解并能承受手术风险的患者,可考虑手术治疗。 中心性浆液性脉络膜视网膜病变是一种古老的疾病,现代各种新技术新疗法如FFA、ICGA、OCT、激光、手术等的出现,不仅使人们对其病机的理解前进了一大步,也使其诊断和治疗获得了突破性的进展。随着生活质量的提高,人们对视觉质量的要求越来越高,对中浆的治疗也提出了新的要求。眼科医生和中浆患者们都不再满足于单纯视敏度的提高,如何最大限度的恢复患者的视功能,包括对比敏感度、像差、立体觉等,将是我们不懈努力的方向。[收起]
60%~80%的中浆患者不用任何治疗3个月内可自愈,10%~20%患者3~6个月内可自愈,自愈后中心视力可恢复正常。但有些患者反复多次发作,长年迁延不愈,形成广泛的色素上皮继发性改变,甚至出现黄斑下机化膜,导致视力大幅度减退甚至永久性丧失。目前关于中浆的治疗措施和时机,还都存在争议。主要的治疗方法有: 1.药物治疗 由于本病确切发病原因不明,目前缺乏针对性的有效药物治疗。大量临床实践证明,激素使用后可加重病情,可发生大泡性视网膜脱离,应避免使用。皮质激素致病变加重的机制不明,推测可能是激素使视网膜色素上皮细胞间的封闭小带松解所致,也可能激素作为免疫抑制剂抑制免疫反应,导致视网膜色...[详细]
中浆属于自限性疾病,3~6个月内不使用任何治疗大部分可自愈。多次复发、病程长的病例可有轻、中度视力减退、视物变形不消退,视功能不能完全恢复正常。

 ②喷出型(又称冒烟型):呈冒烟状,是由于FFA后期染料进入脱离的视网膜下间隙内形成一盘状荧光池所致,占10%~20%(图2)。
②喷出型(又称冒烟型):呈冒烟状,是由于FFA后期染料进入脱离的视网膜下间隙内形成一盘状荧光池所致,占10%~20%(图2)。 ③不典型渗漏点型:病变常呈丛状分布,呈外围亮中央黑的荧光染色点和(或)窗样缺损样或玻璃膜疣状荧光亮点,渗漏不明显或极缓慢,不伴盘状浆液性视网膜脱离,多见于慢性复发性、亚急性或恢复期病例。 同一眼内的渗漏点可以多个,以上3种类型的渗漏也可以同时存在,均在荧光造影静脉期后出现,仅极少数在动脉期出现,这是中浆与脉络膜新生血管膜的重要鉴别点之一,后者的渗漏时间在动脉早期。 (2)局限区RPE渗漏染色型:表现为局限性RPE强荧光染色,渗漏十分缓慢,相应区伴或不伴盘状浆液性视网膜脱离,常伴发广泛RPE失代偿和(或)RPE萎缩带。 (3)RPE浆液性脱离型:FFA早期即显荧光,并逐渐增强,造影后期呈界限清楚、形态大小不变、染色均匀的荧光池,有些病例可以在脱离的RPE上同时伴浆液性视网膜脱离,这种情况下FFA早期出现渗漏点,后期有盘状荧光。 (4)混合复杂型:除了有渗漏性病变[渗漏点和(或)RPE染色和(或)RPE脱离]外,还伴发RPE萎缩带和(或)下方周边部浆液性视网膜脱离。RPE萎缩带范围可以很广,由后极部向下方延伸,有时周边部眼底可有三角综合征的表现。 (5)正常荧光造影所见型:尽管较少见,但也确实存在。推测可能是RPE屏障功能尚未明显损害,不足以渗漏荧光素,但可以渗漏水分子,或是因为RPE渗漏十分缓慢,观察时间不够长,或已是恢复期,渗漏点已封闭,视网膜下液尚未完全吸收的缘故。 2.吲哚青绿荧光血管造影 1986年,Hayashi应用吲哚青绿荧光血管造影(ICGA)观察了5例CSC患者,首先提出中浆视网膜色素上皮功能的损害与脉络膜循环障碍有关。目前ICGA已成为研究CSC病理改变的重要方法,也是诊断该病的主要手段之一,尤其是对于临床表现不典型如老年患者或伴有不典型色素上皮萎缩的CSC患者。中浆的ICGA主要表现有: (1)脉络膜血管低灌注:ICGA早期可见到1处或多处脉络膜血管充盈延迟,呈形态不规则的暗区,直径1~1.5PD,持续10~15s后暗区逐渐消失。FFA于背景期在相应位置出现弱荧光区,迅速消失。 (2)脉络膜血管高渗透:在ICGA早期显示后极部1处或多处异常脉络膜强荧光,有些强荧光区与脉络膜低灌注区明显相关,紧邻于脉络膜低灌注区,或与低灌注区重合。部分强荧光区中可见扩张的脉络膜血管。FFA于相应部位出现点或片状强荧光,出现时间与ICGA一致,但病灶数量一般少于ICGA(图3)。
③不典型渗漏点型:病变常呈丛状分布,呈外围亮中央黑的荧光染色点和(或)窗样缺损样或玻璃膜疣状荧光亮点,渗漏不明显或极缓慢,不伴盘状浆液性视网膜脱离,多见于慢性复发性、亚急性或恢复期病例。 同一眼内的渗漏点可以多个,以上3种类型的渗漏也可以同时存在,均在荧光造影静脉期后出现,仅极少数在动脉期出现,这是中浆与脉络膜新生血管膜的重要鉴别点之一,后者的渗漏时间在动脉早期。 (2)局限区RPE渗漏染色型:表现为局限性RPE强荧光染色,渗漏十分缓慢,相应区伴或不伴盘状浆液性视网膜脱离,常伴发广泛RPE失代偿和(或)RPE萎缩带。 (3)RPE浆液性脱离型:FFA早期即显荧光,并逐渐增强,造影后期呈界限清楚、形态大小不变、染色均匀的荧光池,有些病例可以在脱离的RPE上同时伴浆液性视网膜脱离,这种情况下FFA早期出现渗漏点,后期有盘状荧光。 (4)混合复杂型:除了有渗漏性病变[渗漏点和(或)RPE染色和(或)RPE脱离]外,还伴发RPE萎缩带和(或)下方周边部浆液性视网膜脱离。RPE萎缩带范围可以很广,由后极部向下方延伸,有时周边部眼底可有三角综合征的表现。 (5)正常荧光造影所见型:尽管较少见,但也确实存在。推测可能是RPE屏障功能尚未明显损害,不足以渗漏荧光素,但可以渗漏水分子,或是因为RPE渗漏十分缓慢,观察时间不够长,或已是恢复期,渗漏点已封闭,视网膜下液尚未完全吸收的缘故。 2.吲哚青绿荧光血管造影 1986年,Hayashi应用吲哚青绿荧光血管造影(ICGA)观察了5例CSC患者,首先提出中浆视网膜色素上皮功能的损害与脉络膜循环障碍有关。目前ICGA已成为研究CSC病理改变的重要方法,也是诊断该病的主要手段之一,尤其是对于临床表现不典型如老年患者或伴有不典型色素上皮萎缩的CSC患者。中浆的ICGA主要表现有: (1)脉络膜血管低灌注:ICGA早期可见到1处或多处脉络膜血管充盈延迟,呈形态不规则的暗区,直径1~1.5PD,持续10~15s后暗区逐渐消失。FFA于背景期在相应位置出现弱荧光区,迅速消失。 (2)脉络膜血管高渗透:在ICGA早期显示后极部1处或多处异常脉络膜强荧光,有些强荧光区与脉络膜低灌注区明显相关,紧邻于脉络膜低灌注区,或与低灌注区重合。部分强荧光区中可见扩张的脉络膜血管。FFA于相应部位出现点或片状强荧光,出现时间与ICGA一致,但病灶数量一般少于ICGA(图3)。 (3)荧光渗漏:ICGA晚期弱荧光区内出现孤立的强荧光点。 (4)RPE脱离:ICGA早期表现为强荧光,范围略大于FFA,晚期呈弱荧光表现。 (5)视网膜神经上皮脱离:ICGA晚期后极部呈现圆形或类圆形强荧光,形态规则,边缘光滑,直径2~4PD,与无赤光检查中“盘状脱离”的形态基本一致。 3.中心视野 急性期存在相对或绝对中心暗点,尤其是Amsler表检查暗点更明确,且有视物变形,恢复期后中心视野可以正常。但是对于病程长的病例,或反复多次发作病例,中心视野可能存在相对的暗点。有的病例视力恢复很好,但Amsler表检查中心相对暗点仍存在,视物变形更多见,对比敏感度、后像恢复时间等常不可能完全恢复。
(3)荧光渗漏:ICGA晚期弱荧光区内出现孤立的强荧光点。 (4)RPE脱离:ICGA早期表现为强荧光,范围略大于FFA,晚期呈弱荧光表现。 (5)视网膜神经上皮脱离:ICGA晚期后极部呈现圆形或类圆形强荧光,形态规则,边缘光滑,直径2~4PD,与无赤光检查中“盘状脱离”的形态基本一致。 3.中心视野 急性期存在相对或绝对中心暗点,尤其是Amsler表检查暗点更明确,且有视物变形,恢复期后中心视野可以正常。但是对于病程长的病例,或反复多次发作病例,中心视野可能存在相对的暗点。有的病例视力恢复很好,但Amsler表检查中心相对暗点仍存在,视物变形更多见,对比敏感度、后像恢复时间等常不可能完全恢复。

