-
科室:
心血管内科
-
别名:
家族性高β脂蛋白血症
-
症状:
暂无
-
发病部位:
暂无
-
多发人群:
所有人群
-
相关疾病:
高脂蛋白血症
家族性高胆固醇血症(familial hypercholesterolemia,FH)是一种常染色体显性遗传性疾病。本症的发病机制是细胞膜表面的LDL受体缺如或异常,导致体内LDL代谢异常,造成血浆总胆固醇(TC)水平和低密度脂蛋白-胆固醇(LDL-C)水平升高,临床上常有多部位黄色瘤和早发冠心病。
FH发病原因是LDL受体基因的自然突变。 Goldstein和Brown鉴定出基因突变的不同类型,包括缺失、插入、无义突变和错义突变。迄今,已发现数十种LDL受体基因突变,可分为五大类型: 1.Ⅰ类突变 其特点是突变基因不产生可测定的LDL受体,细胞膜上无LDL受体存在。是最常见的突变类型,约占所发现突变的半数以上。用抗LDL受体多克隆或单克隆抗体检测,证实该类突变的LDL受体基因几乎不产生或仅产生极微量的LDL受体前体。故此类突变的LDL受体基因为无效等位基因,又称无受体合成型突变。命名为受体-O型(R-O)。I类突变的分子基础可能包括LDL受体基因点突变,导致终止在编码受体的密码之前;启动子突变阻断mRNA的转录;内含子与外显子连接处突变使mRNA拼接发生异常和大片段基因DNA缺失等。最近发现一例受体阴性型病人,其LDL受体基因的外显子13与内含子15的Alu序列间缺失5.0kb片段,形成外显子13与Alu重组。 2.Ⅱ类突变 其特点是突变基因合成的LDL受体在细胞内成熟和运输障碍,细胞膜上LDL受体明显减少。亦是较常见的突变类型。突变的基因可产生LDL受体前体,多数分子量正常,故命名为R-120。分析发现这类受体前体的加工修饰发生障碍。该类突变的分子基础尚不十分清楚。有实验证明,这类LDL受体可被抗LDL受体的单克隆抗体识别,说明这类前体在结构上并无变化。Scheckman等对类似Ⅱ类突变的一种酵母转换酶进行了研究,发现该酶的这种缺陷主要是NH2端疏水性信号链中单个氨基酸发生了改变,导致信号链不能脱离酶蛋白,结果这种酶蛋白进入高尔基器的速率仅为正常的2%。将酵母酸性磷酸酶的基因在体外诱导类似突变,导致信号链不能脱离受体前体,使其进入高尔基器加工修饰发生障碍。Ⅱ型突变主要影响LDL受体的1区和2区,以错义突变为多见。然而,由单个氨基酸残基替换或小段DNA缺失引起LDL受体在细胞内转运或成熟受阻的机制尚未完全阐明。 3.Ⅲ类突变 其特点是突变基因合成的LDL受体可到细胞表面,但不能与配体结合。突变的LDL受体基因分子量基本正常,命名为R-160b-,亦有R-140b-和-210b-。Ⅲ型突变因累及LDL受体1区重复片段2~7或2区重复片段A而干扰受体与配体间的正常结合。研究表明,此类突变的LDL受体前体可被抗LDL受体的单克隆抗体识别,分子量亦比成熟受体的分量小40kD,说明受体前体加工修饰过程正常。然而这类突变的受体结合125I-LDL不超过正常的15%,提示成熟LDL受体与125I-LDL结合异常的分子基础可能是受体结合域氨基酸序列发生变化。已知LDL受体结合域有7个重复序列,每个重复序列都具有同源性,因此所编码的DNA序列很容易缺失或形成双倍体出现错误配对,而使受体结合域的结构发生异常,导致与LDL的亲和性降低。 4.Ⅳ类突变 此类突变主要是成熟的LDL受体到达细胞表面后不能被覆陷聚集成族,细胞虽能结合LDL,但不出现内移,亦称内移缺陷型突变。该型突变累及LDL受体的跨膜区(4区)和C端尾区(5区)。Lehrman等研究表明,LDL受体基因的17、18外显子单个碱基突变即可导致内移缺陷型。最近的研究还发现,2名Ⅳ类突变的FH纯合子,其LDL受体基因突变为内含子15与3’端非翻译区的18外显子之间的DNA序列分别缺失5.0kb和7.8kb,形成Alu-Alu序列重组,细胞合成的受体均缺乏跨膜域和胞浆域。这种截短的LDL受体大部分分泌到培养液中,仅少部分黏附在细胞表面非覆陷处,虽能结合LDL,但不发生内移。 5.Ⅴ类突变 这一类LDL受体突变是发生在表皮生长因子前体同源域,其特点是LDL受体的合成、与LDL的结合以及其后的内移均正常,但受体不能再循环到细胞膜上。这种缺陷的LDL受体与LDL结合并进入细胞后,在溶酶体内两者不能分离而同时被降解。 此外,Lehrman报道,黎巴嫩FH发病率较高。对4名FH纯合子患者的LDL受体基因研究,发现其基因突变发生在编码突变第二结构域含Cys序列中段的密码突变成终止密码,结果LDL受体缺乏O-连接糖链、跨膜域及胞浆域,共缺失160个氨基酸残基。这种突变的LDL受体基因被称之为“黎巴嫩等位基因”。 最近Kajinami等研究了35例无亲缘关系的FH杂合子受体基因。随后分析此两例家庭成员的LDL受体基因,发现凡是FH患者,均出现相同的异常LDL受体基因DNA片段。由于他们均生长在日本的Tonami地区,这些患者被称为“FH-Tonami”。[收起]
FH发病原因是LDL受体基因的自然突变。 Goldstein和Brown鉴定出基因突变的不同类型,包括缺失、插入、无义突变和错义突变。迄今,已发现数十种LDL受体基因突变,可分为五大类型: 1.Ⅰ类突变 其特点是突变基因不产生可测定的LDL受体,细胞膜上无LDL受体存在。是最常见的突变类型,约占所发现突变的半数以上。用抗LDL受体多克隆或单克隆抗体检测,证实该类突变的LDL受体基因几乎不产生或仅产生极微量的LDL受体前体。故此类突变的LDL受体基因为无效等位基因,又称无受体合成型突变。命名为受体-O型(R-O)。I类突变的分子基础可能包括LDL受体基因点突变,导致终止在编码受体的...[详细]
由于LDL受体的缺陷可产生体内LDL代谢双重异常,即LDL产生增加和分解减慢,其中最突出的异常是LDL从血浆中分解代谢减低。将已用放射性核素标记的LDL静脉注射进入正常人体内,24h内血浆中LDL平均分解代谢率为45%;同样的LDL静脉注射入杂合子FH患者体内,24h内血浆LDL平均分解代谢率为28.7%;而纯合子患者体内LDL平均分解代谢率为17.6%。这些结果支持从杂合子FH到纯合子FH,随着体内LDL受体活性降低加重,LDL从血浆中清除也相应减少。 在FH患者,除了血浆中LDL分解代谢减慢外,还存在体内LDL过多地产生。在LDL受体正常时,部分IDL可直接被肝脏LDL受体摄取而进行分解代谢,另一部分IDL则转化为LDL。而在FH,由于LDL受体缺陷,使IDL的直接分解代谢受阻,造成更多的IDL转化为LDL。所以,FH患者体内LDL的产生明显增加。[收起]
由于LDL受体的缺陷可产生体内LDL代谢双重异常,即LDL产生增加和分解减慢,其中最突出的异常是LDL从血浆中分解代谢减低。将已用放射性核素标记的LDL静脉注射进入正常人体内,24h内血浆中LDL平均分解代谢率为45%;同样的LDL静脉注射入杂合子FH患者体内,24h内血浆LDL平均分解代谢率为28.7%;而纯合子患者体内LDL平均分解代谢率为17.6%。这些结果支持从杂合子FH到纯合子FH,随着体内LDL受体活性降低加重,LDL从血浆中清除也相应减少。 在FH患者,除了血浆中LDL分解代谢减慢外,还存在体内LDL过多地产生。在LDL受体正常时,部分IDL可直接被肝脏LDL受体摄取...[详细]
FH患者的临床表现取决于其LDL受体缺陷的严重程度。典型杂合子型FH患者的血浆胆固醇浓度是正常人的2~3倍,且在儿童时期便可测定出高胆固醇血症。但有些杂合子FH病人的血浆胆固醇浓度可以是正常或仅稍有升高,这提示基因缺陷所致的受体功能异常可能有程度上的差异。曾有报道纯合子FH的后代血浆胆固醇浓度基本正常。 国内的研究表明,多数确诊的杂合子FH病人的血浆胆固醇浓度只稍高于同性别、同年龄组正常人的95%上限。说明我国人群中杂合子FH病人的LDL受体基因缺陷可能有不同的特点,或其表达更多地受环境因素的影响。国内对8例纯合子FH和15例杂合子FH患者的血清载脂蛋白含量变化进行了观察,发现FH患者血清高密度脂蛋白(HDL)-C和载脂蛋白(Apo)AⅠ有明显的降低,其机制有待阐明。他们也发现纯合子FH患者的皮肤成纤维细胞上HDL受体结合能力及清除胆固醇的能力明显增高,这种改变是否与HDL-C和Apo AⅠ水平降低有关尚不清楚。 高胆固醇血症也促使胆固醇在其他组织沉着。例如吞噬了胆固醇的巨噬细胞可引起各部位在肌腱出现结节性肿胀,称肌腱黄色瘤,以跟腱和手伸肌腱受累为多见。在眼睑也可发生类似的胆固醇沉着,引起扁平状黄色瘤;角膜的胆固醇浸润则引起角膜弓。不过后两者表现并非FH所特有,也可发生于其他类型的高脂血症,亦偶见于正常人。随着年龄的增长,肌腱黄色瘤则更为常见,约75%的FH病人最终会出现肌腱黄色瘤。但也应该注意到,由于肌腱黄色瘤并不是所有的FH病人都会出现,所以没有发现肌腱黄色瘤并不能排除该病的诊断。 在男性杂合子型FH患者,30~40岁时便可患有冠心病。男性预期23%患者在50岁以前死于冠心病,50%以上的男性患者在60岁时已有明显的冠心病症状。而在女性杂合子FH患者虽也易患冠心病,但发生冠心病的年龄较男性患者晚10年左右。 纯合子FH患者是由于从其父母各遗传获得一个异常的LDL受体基因,患者体内无或几乎无功能性的LDL受体,因而造成患者血浆胆固醇水平较正常人高出6~8倍。常较早发生动脉粥样硬化,多在10余岁时就出现冠心病的临床症状和体征,如得不到有效的治疗,这些病人很难活到30岁。 纯合子FH的一个特征性表现是,在降主动脉易发生广泛的动脉粥样硬化。由于胆固醇和其他脂质浸润主动脉瓣叶,也可发生主动脉瓣狭窄。冠状动脉亦有典型的粥样斑块,但管腔狭窄常见于冠状动脉开口处。其他部位的动脉亦可发生粥样硬化。例如颈动脉粥样硬化可引起颈动脉狭窄,可在颈动脉部位听到血管杂音。 B型超声仪对检查和随访FH患者的心血管改变最为敏感。虽然在早期患者并无临床表现,体格检查和心电图均未发现异常改变,但B型超声检查常可发现主动脉根部硬化。随着心绞痛症状的出现以及高胆固醇血症持续时间的增长(即年龄增大),主动脉根部硬化逐渐加重,同时可出现主动脉瓣钙化和(或)左冠状动脉主干狭窄。 最近有人对197例杂合子FH患者进行了冠状动脉造影研究,发现其中15%有冠状动脉瘤样扩张(指冠状动脉的局限或弥漫性扩张,其直径超过了相邻正常冠脉的1.5~2倍),并同时发现冠状动脉瘤样扩张与血浆HDL-C水平呈负相关,因而认为FH者易发生冠状动脉瘤样性疾病。 FH患者发生动脉粥样硬化的危险性显然与其血浆胆固醇水平升高的程度和时间有着密切的关系。有人研究了17例纯合子FH患者,将血浆胆固醇浓度与患者诊断FH后的时间(年)相乘,即计算出患者的动脉粥样硬化的危险系数(血浆胆固醇·年),该系数能更准确地预测患者动脉粥样硬化的严重程度。[收起]
FH患者的临床表现取决于其LDL受体缺陷的严重程度。典型杂合子型FH患者的血浆胆固醇浓度是正常人的2~3倍,且在儿童时期便可测定出高胆固醇血症。但有些杂合子FH病人的血浆胆固醇浓度可以是正常或仅稍有升高,这提示基因缺陷所致的受体功能异常可能有程度上的差异。曾有报道纯合子FH的后代血浆胆固醇浓度基本正常。 国内的研究表明,多数确诊的杂合子FH病人的血浆胆固醇浓度只稍高于同性别、同年龄组正常人的95%上限。说明我国人群中杂合子FH病人的LDL受体基因缺陷可能有不同的特点,或其表达更多地受环境因素的影响。国内对8例纯合子FH和15例杂合子FH患者的血清载脂蛋白含量变化进行了观察,发现FH...[详细]
本病患者中并发冠心病的比例明显增高、发病早、程度重,预后差;此外还有主动脉(降主动脉、颈动脉等)广泛粥样硬化;冠状动脉瘤样扩张等。
1.血浆胆固醇浓度增高 超过9.1mmol/L(350mg/dl),一般不伴有高三酰甘油血症;但大约10%的FH患者亦同时有高三酰甘油血症。 2.血LDL-C呈持续性增高。 3.LDL受体功能测定 应用细胞培养的方法对LDL受体功能进行测定,有助于FH的诊断。最早报道的方法是将125碘(125I)与病人的成纤维细胞一起进行培养,然后分别进行125I结合125I内移和125I降解测定,并与正常人的成纤维细胞对照比较,凡LDL受体活性在正常的25%以下者即可诊断FH。
1.B型超声仪 对检查和随访FH患者的心血管改变最为敏感。B型超声检查常可发现主动脉根部硬化。主动脉根部硬化逐渐加重,同时可出现主动脉瓣钙化和(或)左冠状动脉主干狭窄。 2.冠状动脉造影 发现其中15%有冠状动脉瘤样扩张(指冠状动脉的局限或弥漫性扩张,其直径超过了相邻正常冠脉的1.5~2倍),而年龄、性别配对的对照组(非FH冠心病患者)中仅2.5%有冠状动脉瘤样扩张。并同时发现冠状动脉瘤样扩张与血浆HDL-C水平呈负相关,因而认为FH者易发生冠状动脉瘤样性疾病。
1.单纯性家族性高胆固醇血症的诊断依据 (1)血浆胆固醇的浓度超过9.1mmol/L(350mg/dl),诊断FH几乎无困难。 (2)血浆LDL呈持续性增高,出生后即可测知。 (3)如合并以下其他表现则更支持FH的诊断: ①患者本人或其第一级亲属中有肌腱黄色瘤者。 ②患者第一代亲属中有高胆固醇血症者。 ③患者家庭成员中有儿童期就被检出有高胆固醇血症者。 2.杂合子家族性高胆固醇血症 血浆胆固醇浓度为6.5~9.1mmol/L(250~350mg/dl),若同时有上述其他特征之一者,则可作出FH的诊断。 有人根据患者的家族史、检出时的年龄和血浆胆固醇水平,提出了FH的诊断标准(表1),其特异性和敏感性分别为98%和87%。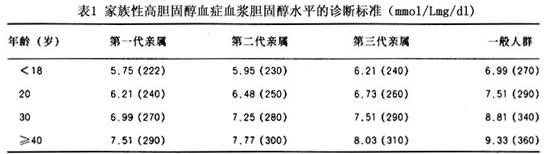 [收起]
1.单纯性家族性高胆固醇血症的诊断依据 (1)血浆胆固醇的浓度超过9.1mmol/L(350mg/dl),诊断FH几乎无困难。 (2)血浆LDL呈持续性增高,出生后即可测知。 (3)如合并以下其他表现则更支持FH的诊断: ①患者本人或其第一级亲属中有肌腱黄色瘤者。 ②患者第一代亲属中有高胆固醇血症者。 ③患者家庭成员中有儿童期就被检出有高胆固醇血症者。 2.杂合子家族性高胆固醇血症 血浆胆固醇浓度为6.5~9.1mmol/L(250~350mg/dl),若同时有上述其他特征之一者,则可作出FH的诊断。 ...[详细]
[收起]
1.单纯性家族性高胆固醇血症的诊断依据 (1)血浆胆固醇的浓度超过9.1mmol/L(350mg/dl),诊断FH几乎无困难。 (2)血浆LDL呈持续性增高,出生后即可测知。 (3)如合并以下其他表现则更支持FH的诊断: ①患者本人或其第一级亲属中有肌腱黄色瘤者。 ②患者第一代亲属中有高胆固醇血症者。 ③患者家庭成员中有儿童期就被检出有高胆固醇血症者。 2.杂合子家族性高胆固醇血症 血浆胆固醇浓度为6.5~9.1mmol/L(250~350mg/dl),若同时有上述其他特征之一者,则可作出FH的诊断。 ...[详细]
1.饮食治疗 对FH患者来说是一种很重要的方法。有研究表明,FH患者对饮食治疗的反应较血浆胆固醇水平正常者和血浆胆固醇水平轻度升高者更为敏感。动物试验已证实,食物中的胆固醇和脂肪酸可下调肝细胞膜上LDL受体的活性,所以,对于FH患者应限制这两类饮食成分的摄入。 2.降脂药物 β-羟基β-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂是治疗FH患者的首选药物,与其他降脂药物如胆酸螯合剂合用,则可使70%的杂合子型FH患者的LDL-C水平降至正常。FH患者对降脂药物的反应取决于个体自身LDL受体突变的类型及其残存的LDL受体活性程度。其他因素也影响HMG-CoA还原酶抑制剂治疗FH患者的效果,其中最突出的因素是在Apo E3基因型者为40.7%,而在Apo E2基因型者为46.5%。 基于目前对于HMG-CoA还原酶抑制降胆固醇的作用机制,一般认为这类药物对于纯合子型FH患者无治疗效果。但最近有报道对于无LDL受体功能活性的FH患者,辛伐他汀(Simvastain)可使其胆固醇水平降低30%,提示辛伐他汀可能还具有其他降胆固醇作用机制。 3.血浆LDL分离法 是治疗FH的有效方法。有报道某些病人已接受这种治疗长达16年,虽然这些患者在童年时期的血浆胆固醇水平高于25.0mmol/L,然而30年后仍然无冠心病的临床表现。 4.中药 国内报道应用问荷降脂片(由中药问荆、荷叶、川芎、花椒等组成)治疗5例纯合子FH的临床效果,治疗15个月后,血浆胆固醇水平从19.22mmol/L(742mg/dl)降至14.81mmol/L(572mg/dl),且无明显副作用。[收起]
1.饮食治疗 对FH患者来说是一种很重要的方法。有研究表明,FH患者对饮食治疗的反应较血浆胆固醇水平正常者和血浆胆固醇水平轻度升高者更为敏感。动物试验已证实,食物中的胆固醇和脂肪酸可下调肝细胞膜上LDL受体的活性,所以,对于FH患者应限制这两类饮食成分的摄入。 2.降脂药物 β-羟基β-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂是治疗FH患者的首选药物,与其他降脂药物如胆酸螯合剂合用,则可使70%的杂合子型FH患者的LDL-C水平降至正常。FH患者对降脂药物的反应取决于个体自身LDL受体突变的类型及其残存的LDL受体活性程度。其他因素也影响HMG-CoA还原酶抑制剂治疗FH...[详细]
男性杂合子型FH患者,30~40岁时便可患有冠心病。男性预期23%患者在50岁以前死于冠心病,50%以上的男性患者在60岁时已有明显的冠心病症状。而在女性杂合子FH患者虽也易患冠心病,但发生冠心病的年龄较男性患者晚10年左右。 纯合子FH患者是由于从其父母各遗传获得一个异常的LDL受体基因,患者体内无或几乎无功能性的LDL受体,因而造成患者血浆胆固醇水平较正常人高出6~8倍。常较早发生动脉粥样硬化,多在10余岁时就出现冠心病的临床症状和体征,如得不到有效的治疗,这些病人很难活到30岁。
1.目前对本病尚无很好的预防办法,要加强防治人员对本病的认识,了解本病的危害和严重后果。 2.患有此病的患者要主动接受低脂肪和低碳水化合物饮食治疗。及时选用适宜的降血脂药物坚持治疗。 3.患者要定期检测个人的血脂,使之维持在正常水平。 4.积极预防并发症。




