-
科室:
呼吸内科
-
别名:
obstructive emphysema
-
症状:
暂无
-
发病部位:
暂无
-
多发人群:
吸烟、慢支患者
-
相关疾病:
肺气肿
阻塞性肺气肿(obstructive pulmonary emphysema)是指终末细支气管远端气囊腔(包括呼吸性细支气管、肺泡管、肺泡囊和肺泡)的持久性膨胀、扩大,伴气腔壁结构破坏而无明显纤维化为病理特征的一种疾病。多由长期吸烟、大气污染、吸入有害化学物质和粉尘以及慢性反复呼吸道感染等诱发慢性支气管炎,进一步发展为本病。
1.慢性支气管炎症性损伤 引起慢性支气管炎的各种因素如感染、吸烟、大气污染、职业性粉尘和有害气体的长期吸入,以及过敏因素等均可引起支气管慢性炎症,使管腔狭窄形成不完全阻塞,使吸气时气体容易进入肺泡,而呼气时由于胸膜腔内压力增加,支气管进一步闭合,导致肺泡中残留气体过多和肺泡过度充气。慢性炎症还可损伤小支气管壁软骨组织,使支气管失去正常的支架作用,和呼气时支气管易于陷闭,阻碍气体排出,导致肺泡内气体积聚过多,肺泡内压力升高和过度膨胀。此外,由于肺泡内压的增高,使肺泡壁的毛细血管受压,肺组织血液供应减少和营养障碍,亦可引起肺泡壁弹性减退。因此,慢性支气管炎症性损伤为引起阻塞性肺气肿的重要原因。 2.蛋白酶-抗蛋白酶平衡失调 目前认为体内的某些蛋白水解酶对肺组织具有损伤破坏的作用,而抗蛋白酶对于弹力蛋白酶等多种蛋白酶具有抑制的效能。蛋白酶和抗蛋白酶维持平衡是保证肺组织正常结构免受破坏的重要因素。 3.遗传因素 肺气肿的发生还与遗传因素有关。正常人血清中α1-AT是按常染色体隐性基因遗传的。[收起]
1.慢性支气管炎症性损伤 引起慢性支气管炎的各种因素如感染、吸烟、大气污染、职业性粉尘和有害气体的长期吸入,以及过敏因素等均可引起支气管慢性炎症,使管腔狭窄形成不完全阻塞,使吸气时气体容易进入肺泡,而呼气时由于胸膜腔内压力增加,支气管进一步闭合,导致肺泡中残留气体过多和肺泡过度充气。慢性炎症还可损伤小支气管壁软骨组织,使支气管失去正常的支架作用,和呼气时支气管易于陷闭,阻碍气体排出,导致肺泡内气体积聚过多,肺泡内压力升高和过度膨胀。此外,由于肺泡内压的增高,使肺泡壁的毛细血管受压,肺组织血液供应减少和营养障碍,亦可引起肺泡壁弹性减退。因此,慢性支气管炎症性损伤为引起阻塞性肺气肿的重要原因。...[详细]
1.慢性支气管炎症性损伤 引起慢性支气管炎的各种因素如感染、吸烟、大气污染、职业性粉尘和有害气体的长期吸入,以及过敏因素等均可引起支气管慢性炎症,使管腔狭窄形成不完全阻塞,使吸气时气体容易进入肺泡,而呼气时由于胸膜腔内压力增加,支气管进一步闭合,导致肺泡中残留气体过多和肺泡过度充气。慢性炎症还可损伤小支气管壁软骨组织,使支气管失去正常的支架作用,和呼气时支气管易于陷闭,阻碍气体排出,导致肺泡内气体积聚过多,肺泡内压力升高和过度膨胀。此外,由于肺泡内压的增高,使肺泡壁的毛细血管受压,肺组织血液供应减少和营养障碍,亦可引起肺泡壁弹性减退。因此,慢性支气管炎症性损伤为引起阻塞性肺气肿的重要原因。 COPD气道炎症的发生机制为,当机体因吸烟、感染及环境污染等因素刺激时,单核细胞、巨噬细胞及中性粒细胞等迅速合成并释放细胞因子,如IL-1、TNF-α、IFN等,这些因子可诱导血管内皮细胞合成黏附分子(ICAM-1,VCAM-1)增加。此外,还可激活白细胞表面的黏附分子(LFA-1,VLA-4,MAC-1等)使其表达上调,并与内皮细胞上相应的黏附分子相互作用,导致白细胞快速黏附,并跨越内皮转移到炎症部位参与炎症反应。同时上述的致病因素,如吸烟、感染等对肺组织的损伤亦可刺激上皮细胞、巨噬细胞产生中性粒细胞趋化因子IL-8、巨噬细胞炎症蛋白-2(MIP-2),激活并趋化中性粒细胞在靶部位聚集,从而加重了炎症反应。此外,活化的中性粒细胞释放的蛋白分解酶和弹性蛋白酶可使支气管上皮脱落,纤毛运动减退,黏液分泌亢进,导致黏液潴留和细菌繁殖,使炎症反复发作并迁延不愈。 2.蛋白酶-抗蛋白酶平衡失调 目前认为体内的某些蛋白水解酶对肺组织具有损伤破坏的作用,而抗蛋白酶对于弹力蛋白酶等多种蛋白酶具有抑制的效能。蛋白酶和抗蛋白酶维持平衡是保证肺组织正常结构免受破坏的重要因素。如抗蛋白酶不足或蛋白酶增加均可导致肺组织结构破坏发生肺气肿。 (1)抗蛋白酶:人体中的抗蛋白酶系统,即蛋白溶解酶的抑制物(protease inhibitor),其中α1-抗胰蛋白酶(α1-AT)是活性最强的一种。此外,还有α2-巨球蛋白(α2-M)和抗白细胞蛋白酶(antileukoprotease,ALP)。α1-AT是一种急性相反应蛋白,由肝脏合成,分子量45~56KD,正常血清浓度为1360±176mg/L。在感染等多种炎症反应中血清α1-AT水平可升高,可抑制多种丝氨酸蛋白酶的活性。α2-M主要亦由肝细胞合成,分子量大,当血管通透性增加时,肺组织中水平始升高,ALP的合成与排泌均在气道,具有灭活弹性蛋白酶的效能。因此,正常情况下,α1-AT、α2-M及ALP协同发挥保护肺和气道,使其不被蛋白酶所破坏。 (2)蛋白酶:破坏肺组织的蛋白酶其主要来源有二:一来自病原菌的外源性蛋白酶;二来自中性粒细胞和巨噬细胞的内源性蛋白酶,其中以人中性弹性蛋白酶(HNE)最为重要,与肺气肿发病也最为密切。HNE为一种丝氨酸蛋白酶,每个中性粒细胞内约含3mg,106个粒细胞在体外能水解0.4mg肺弹性硬蛋白。α1-AT可与HNE呈1∶1结合成不易解离的复合体,使弹性蛋白酶灭活。巨噬细胞弹性蛋白酶则为一种金属蛋白酶,需有金属离子存在始能发挥作用。巨噬细胞中的蛋白酶含量仅相当于中性粒细胞的1/10,它不受α1-AT抑制,反而可使α1-AT水解而失去抗HNE的作用。 当支气管-肺发生感染时或纸烟烟雾和其他有害物质长期刺激下,肺泡巨噬细胞和中性粒细胞大量聚集并活化,释出弹性蛋白酶,当蛋白酶的含量和活性超过了局部肺组织中抗蛋白酶(α1-AT为主)的抑制效能时,弹性硬蛋白则被降解,引起肺组织消融,肺泡间隔毁坏,肺泡腔扩大,小气道在呼气时失去了周围间隔的支持而陷闭。导致了肺气肿的发生。 此外,在肺气肿发生过程中,中性粒细胞和肺泡巨噬细胞还生成并释放氧自由基,将α1-AT中具有活性的核心蛋氨酸氧化而形成亚砜,从而使其抗蛋白酶的活性明显降低。吸烟者的α1-AT活性仅为不吸烟者的60%,因此,吸烟可破坏蛋白酶-抗蛋白酶系统的平衡,促进肺气肿的发生和发展。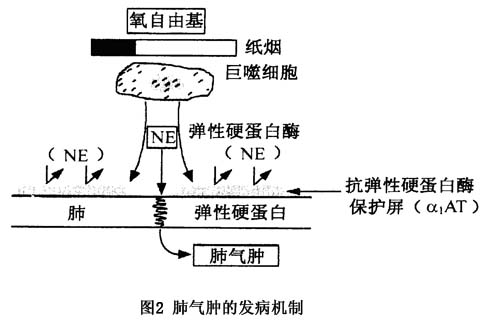 3.遗传因素 肺气肿的发生还与遗传因素有关。正常人血清中α1-AT是按常染色体隐性基因遗传的。在遗传过程中,正常人群绝大多数均由2个M型等位基因组成的纯合子,遗传表现型为PiMM,携带者的α1-AT血清浓度正常(>250mg/dl)。由2个Z型等位基因组成的纯合子,PiZZ为其表型,其血清α1-AT仅为正常人的10%~15%(<50mg/dl),携带该遗传表型者为数很少,白种人群中仅约1∶2000(0.05%~0.07%);此外,与α1-AT缺乏有关的纯合子,其遗传表型为PiSS。至于由两个不同等位基因组合者为杂合子,遗传表型以PiMZ较多(4%~4.7%),其次为PiMS(0.5%)和PiSZ(0.08%~0.14%),其余的杂合子表型则更常见。根据对3724名国人调查表明,α1-AT遗传表型主要仍为PiMM,未发现1例PiZZ纯合子,其他类型如PiSS以及PiMZ和PiSZ等肺气肿发生率亦不高。因此,遗传性α1-AT缺乏所致的肺气肿在我国并不重要。 4.病理改变 大体检查见肺过度膨胀,弹性减退,剖胸后肺脏不能回缩。外观灰白或苍白,表面可见多个大小不一的大泡。镜下见终末细支气管远端气囊腔膨胀,间隔变窄,弹力纤维变细或断裂。肺泡壁变薄,肺泡孔扩大,肺泡破裂或形成大泡。与细支气管伴行的肺小血管呈炎症改变,中膜平滑肌水肿、变性和坏死,管腔狭窄甚至闭塞。因肺泡破裂和炎症的侵蚀破坏,肺毛细血管床数量及横断面积均减少。肺气肿时细支气管的病理改变与慢性支气管炎相同。
3.遗传因素 肺气肿的发生还与遗传因素有关。正常人血清中α1-AT是按常染色体隐性基因遗传的。在遗传过程中,正常人群绝大多数均由2个M型等位基因组成的纯合子,遗传表现型为PiMM,携带者的α1-AT血清浓度正常(>250mg/dl)。由2个Z型等位基因组成的纯合子,PiZZ为其表型,其血清α1-AT仅为正常人的10%~15%(<50mg/dl),携带该遗传表型者为数很少,白种人群中仅约1∶2000(0.05%~0.07%);此外,与α1-AT缺乏有关的纯合子,其遗传表型为PiSS。至于由两个不同等位基因组合者为杂合子,遗传表型以PiMZ较多(4%~4.7%),其次为PiMS(0.5%)和PiSZ(0.08%~0.14%),其余的杂合子表型则更常见。根据对3724名国人调查表明,α1-AT遗传表型主要仍为PiMM,未发现1例PiZZ纯合子,其他类型如PiSS以及PiMZ和PiSZ等肺气肿发生率亦不高。因此,遗传性α1-AT缺乏所致的肺气肿在我国并不重要。 4.病理改变 大体检查见肺过度膨胀,弹性减退,剖胸后肺脏不能回缩。外观灰白或苍白,表面可见多个大小不一的大泡。镜下见终末细支气管远端气囊腔膨胀,间隔变窄,弹力纤维变细或断裂。肺泡壁变薄,肺泡孔扩大,肺泡破裂或形成大泡。与细支气管伴行的肺小血管呈炎症改变,中膜平滑肌水肿、变性和坏死,管腔狭窄甚至闭塞。因肺泡破裂和炎症的侵蚀破坏,肺毛细血管床数量及横断面积均减少。肺气肿时细支气管的病理改变与慢性支气管炎相同。
[收起]
1.慢性支气管炎症性损伤 引起慢性支气管炎的各种因素如感染、吸烟、大气污染、职业性粉尘和有害气体的长期吸入,以及过敏因素等均可引起支气管慢性炎症,使管腔狭窄形成不完全阻塞,使吸气时气体容易进入肺泡,而呼气时由于胸膜腔内压力增加,支气管进一步闭合,导致肺泡中残留气体过多和肺泡过度充气。慢性炎症还可损伤小支气管壁软骨组织,使支气管失去正常的支架作用,和呼气时支气管易于陷闭,阻碍气体排出,导致肺泡内气体积聚过多,肺泡内压力升高和过度膨胀。此外,由于肺泡内压的增高,使肺泡壁的毛细血管受压,肺组织血液供应减少和营养障碍,亦可引起肺泡壁弹性减退。因此,慢性支气管炎症性损伤为引起阻塞性肺气肿的重要原因。...[详细]
1.症状 慢性支气管炎并发肺气肿时,常在原有慢性支气管炎症状如咳嗽、咳痰等的基础上出现逐渐加重的呼吸困难。早期仅在活动后如劳动、登楼、上坡或快步行走时感气急;随着病变的发展,在平地活动亦感气短。若在日常生活如说话、穿衣、洗漱,甚至静息时亦感气急,提示肺气肿已属重度。此外,尚有疲乏、食欲缺乏和体重减轻等全身症状。急性发作期呼吸功能进一步减退,每出现低氧血症和高碳酸血症的症状,如胸闷、呼吸困难、头痛、嗜睡和神志恍惚等。合并右心衰竭时可出现相应的症状,参阅慢性肺心病节。 2.体征 一般早期体征不明显。随着病情的发展,严重肺气肿者可见胸廓前后径增加,肋间隙丰满,外观呈桶状,呼吸运动减弱。触诊语颤减弱或消失。叩诊呈过清音。心浊音界缩小或不易叩出,肺下界和肝浊音界下移。听诊心音遥远,呼气相延长,呼吸音普遍减弱,并发感染时肺部可闻及干、湿啰音。如剑下见及心脏搏动,该处心音较心尖部明显时,提示已有右心受累的可能。 3.分型 根据本病的临床表现,阻塞性肺气肿可分为两种类型。 (1)肺气肿型(pink puffer,红喘型,PP型):肺气肿较严重,但支气管病变相对较轻。多见于老年,体质消瘦的患者,呼吸困难严重而发绀不明显。患者两肩高耸、双手扶床、呼气时双颊高鼓并缩唇。胸片见双肺透光度增加。通气功能障碍不如支气管炎型严重,气体分布相对均匀,残气量与肺总量比值增大,肺泡通气量正常或有通气过度,故PaO2降低不明显,PaCO2正常或降低。 (2)支气管炎型(blue bloater,紫肿型,BB型):支气管病变较重,黏膜肿胀和黏液腺增生明显,而肺气肿相对较轻。患者常有多年咳嗽、咳痰史。体质肥胖、发绀、颈静脉怒张、下肢水肿,两肺底闻及湿啰音。胸片见肺纹理增粗,肺气肿征不明显。通气功能明显损害,气体分布不匀,功能残气量与肺总量增加,弥散功能正常,PaO2降低,PaCO2升高。血细胞比容增高,易发展为右心衰竭。[收起]
1.症状 慢性支气管炎并发肺气肿时,常在原有慢性支气管炎症状如咳嗽、咳痰等的基础上出现逐渐加重的呼吸困难。早期仅在活动后如劳动、登楼、上坡或快步行走时感气急;随着病变的发展,在平地活动亦感气短。若在日常生活如说话、穿衣、洗漱,甚至静息时亦感气急,提示肺气肿已属重度。此外,尚有疲乏、食欲缺乏和体重减轻等全身症状。急性发作期呼吸功能进一步减退,每出现低氧血症和高碳酸血症的症状,如胸闷、呼吸困难、头痛、嗜睡和神志恍惚等。合并右心衰竭时可出现相应的症状,参阅慢性肺心病节。 2.体征 一般早期体征不明显。随着病情的发展,严重肺气肿者可见胸廓前后径增加,肋间隙丰满,外观呈桶状,呼吸运动减弱...[详细]
1.自发性气胸 因胸膜下肺大泡破裂,空气进入胸膜腔所致。患者常突感胸痛,呼吸困难加重,发绀明显。叩诊患侧呈鼓音。呼吸音减弱或消失,语颤每减弱。通过X线检查可确诊。 2.呼吸衰竭 阻塞性肺气肿患者在肺功能严重障碍的基础上,往往由于某些诱因如呼吸道感染、痰液引流不畅,不适当氧疗、应用镇静剂和手术麻醉等,常可引起肺功能障碍进一步加重,从而导致呼吸衰竭。 3.慢性肺心病 阻塞性肺气肿患者由于肺泡毛细血管床破坏、气体交换面积减少,以及低氧血症和高碳酸血症等均可引起肺动脉高压。当肺气肿进一步加重或反复并发呼吸道感染,血气分析进行性恶化时,肺动脉压可明显持续升高,右心负荷加重,进而发生右心室肥大,甚或右心衰竭。[收起]
1.自发性气胸 因胸膜下肺大泡破裂,空气进入胸膜腔所致。患者常突感胸痛,呼吸困难加重,发绀明显。叩诊患侧呈鼓音。呼吸音减弱或消失,语颤每减弱。通过X线检查可确诊。 2.呼吸衰竭 阻塞性肺气肿患者在肺功能严重障碍的基础上,往往由于某些诱因如呼吸道感染、痰液引流不畅,不适当氧疗、应用镇静剂和手术麻醉等,常可引起肺功能障碍进一步加重,从而导致呼吸衰竭。 3.慢性肺心病 阻塞性肺气肿患者由于肺泡毛细血管床破坏、气体交换面积减少,以及低氧血症和高碳酸血症等均可引起肺动脉高压。当肺气肿进一步加重或反复并发呼吸道感染,血气分析进行性恶化时,肺动脉压可明显持续升高,右心负荷加重,...[详细]
1.血液检查 部分患者可出现红细胞增多,特别当PaO2<7.3kPa(55mmHg)时为明显。白细胞多正常,合并呼吸道感染时可增高。 2.血气分析 由于换气功能障碍可出现低氧血症,则PaO2降低。虽通气负荷增大,但早期通过代偿,使PaCO2仍维持在正常范围内。当病情进一步发展,可伴发CO2潴留,则PaCO 2升高,引起呼吸性酸中毒。
X线检查:胸廓扩张饱满,肺容积增大,肋间隙增宽,肋骨平举。侧位胸片见胸廓前后径增宽,心前间隙增大。横膈低位,膈穹隆变平。肺野透光度增大,有时可见局限性透光度增高的局限性肺气肿或肺大泡。肺野外带肺血管纹理纤细、稀疏、变直;而内带纹理可增粗、紊乱。心脏常呈垂直位,心影狭长。透视下可见胸廓和膈肌动度减弱。 肺功能检查 强调早期测定,长期动态观察,及时发现,及早诊断。 肺容量测定残气量(RV)。 肺总量(TLC)增加。 残气量/肺总量比值 RV/TLC常>40%。 通气功能测定气道阻力增高,用力呼气流速降低。 一秒用力呼气量第1秒用力呼气量(FEV1)降低。 一秒用力呼出量/用力肺活量比值FEV1/用力肺活量(FVC)常<60%。 最大通气量(MVV)占预计值百分比<80%。 肺静态顺应性(Cst)增加,动态顺应性(Cdyn)降低。 一氧化碳弥散量CO弥散量(DLCO)降低。以上这些对诊断阻塞性肺气肿均有重要的价值。根据FEV1下降程度,可将阻塞性肺气肿分为I、Ⅱ、Ⅲ3级(表1)。 胸部的CT检查特别是薄层高分辨CT(HRCT)可确定小叶中央型或全小叶型肺气肿等病变,了解肺大泡的大小和数量,估计非大泡区域肺气肿的程度,对预计手术治疗效果有一定的意义。但不应作为常规检查。[收起]
X线检查:胸廓扩张饱满,肺容积增大,肋间隙增宽,肋骨平举。侧位胸片见胸廓前后径增宽,心前间隙增大。横膈低位,膈穹隆变平。肺野透光度增大,有时可见局限性透光度增高的局限性肺气肿或肺大泡。肺野外带肺血管纹理纤细、稀疏、变直;而内带纹理可增粗、紊乱。心脏常呈垂直位,心影狭长。透视下可见胸廓和膈肌动度减弱。 肺功能检查 强调早期测定,长期动态观察,及时发现,及早诊断。 肺容量测定残气量(RV)。 肺总量(TLC)增加。 残气量/肺总量比值 RV/TLC常>40%。 通气功能测定气道阻力增高,用力呼气流速降低。 一秒用力呼气量第1秒用力呼气量...[详细]
胸部的CT检查特别是薄层高分辨CT(HRCT)可确定小叶中央型或全小叶型肺气肿等病变,了解肺大泡的大小和数量,估计非大泡区域肺气肿的程度,对预计手术治疗效果有一定的意义。但不应作为常规检查。[收起]
X线检查:胸廓扩张饱满,肺容积增大,肋间隙增宽,肋骨平举。侧位胸片见胸廓前后径增宽,心前间隙增大。横膈低位,膈穹隆变平。肺野透光度增大,有时可见局限性透光度增高的局限性肺气肿或肺大泡。肺野外带肺血管纹理纤细、稀疏、变直;而内带纹理可增粗、紊乱。心脏常呈垂直位,心影狭长。透视下可见胸廓和膈肌动度减弱。 肺功能检查 强调早期测定,长期动态观察,及时发现,及早诊断。 肺容量测定残气量(RV)。 肺总量(TLC)增加。 残气量/肺总量比值 RV/TLC常>40%。 通气功能测定气道阻力增高,用力呼气流速降低。 一秒用力呼气量第1秒用力呼气量...[详细]
根据逐渐加重的气短或呼吸困难的病史,肺气肿或肺过度充气的体征和X线表现,以及肺功能检查通气和换气功能障碍的表现,或经支气管扩张药治疗后,肺功能无明显改善者,阻塞性肺气肿的诊断即可成立。
目的在于阻止症状发展和疾病的反复加重;保持最适当的肺功能;改善活动能力,提高生活质量。具体措施如下。 1.停止吸烟 吸烟是引起阻塞性肺气肿的主要危险因素,停止吸烟是治疗的重要措施之一。众所周知,呼吸功能随年龄的增长而减退,在不吸烟的正常人群中,25~30岁以后,FEV1每年约下降25~30ml,吸烟者FEV1下降较不吸烟者明显,其下降的曲线陡直,以重度吸烟者更为显著。吸烟者中约10%~15%为COPD的易感者,在这些人群中FEV1的下降更为严重,每年下降约150ml,当其至60岁时FEV1平均仅0.8L,此时常感呼吸困难,难以胜任日常活动,已经达到致残的地步。然而,如能在50岁时戒烟,肺功能虽已不能恢复,但FEV1随年龄增长而下降的速度将沿着不吸烟者的规律发展,出现呼吸困难的年龄将向后推移11年左右,至76岁时始较明显。可见尽早戒烟在治疗阻塞性肺气肿方面具有十分重要的意义。 2.抗感染药物、支气管扩张药及祛痰药的应用。 3.糖皮质激素 COPD患者使用糖皮质激素疗效不如哮喘患者,故应持慎重态度。鉴于COPD气道炎症的本质与哮喘不尽相同,前者是由于吸烟、感染、过敏及环境污染等综合因素引起,而后者则主要为变态反应引起的非特异性炎症反应。COPD患者仅部分存在气道高反应性和气道对β2受体激动药吸入的部分可逆性,且多数患者吸入皮质激素不能改变乙酰胆碱对气道激发试验的反应性。因此,建议COPD患者应用皮质激素吸入治疗应具有如下的指征: (1)应用β2受体激动药吸入后FEV1较用药前增加≥15%,其气流受阻具有一定的可逆性者。 (2)支气管激发试验呈气道高反应性者。 (3)痰或周围血嗜酸性粒细胞增高者。 (4)对多种过敏原皮肤试验,50%以上呈阳性的特应质者。 (5)血或支气管肺泡灌洗液中,白介素(ILs)、肿瘤坏死因子(TNF-α)及γ-干扰素(IFN-γ)等细胞因子,或血栓素A2(TXA2)、白三烯(LTs)、前列腺素F2-α(PGF2-α)及血小板激活因子(PAF)等炎症介质水平升高者。 (6)COPD合并哮喘者。一般可考虑口服或静脉滴注糖皮质激素,以中等剂量泼尼松20~30mg/d口服开始,如患者主观症状、肺功能及血气有所改善,可逐渐减至最小有效维持量,一般口服3~4周,症状缓解即应停用。据报告稳定期患者应用皮质激素吸入治疗,仅10%左右患者FEV1可获改善,故局部吸入皮质激素疗效尚不满意。 4.氧疗 (1)医院内氧疗:COPD急性加重期严重缺氧时氧疗的目的是使动脉血氧饱和度(SaO2)上升至>90%及PaO2≥8.0kPa(60mmHg),而不使PaCO2上升超过1.3kPa(10mmHg)。一般可通过鼻导管、Venturi.面罩或机械通气给氧。吸氧应从低浓度开始,鼻导管吸氧的流量为1~2L/min。如严重低氧血症而CO2潴留不甚严重者,可逐步适当增加吸氧浓度。 (2)长程家庭氧疗(LTOT):可提高COPD伴慢性呼吸衰竭患者的生存率和生活质量。呼吸衰竭稳定3~4周,PaO2≤7.3kPa(55mmHg),不管有无高碳酸血症均有进行LTOT的指征。一般经鼻导管吸氧,流量1.5~2.5L/min,PaO2可升达8.0kPa(60mmHg)以上。吸氧持续时间不应<15h/d。 5.营养支持 阻塞性肺气肿患者由于呼吸负荷加重,呼吸作功增加能量消耗过多,长期慢性咳嗽、咳痰和反复感染的消耗以及气急、缺氧和药物等的影响,使患者摄入减少,常合并营养不良。从而加重呼吸肌无力和疲劳,以及免疫功能进一步减弱。因此,营养支持疗法日益受到重视。应采用对本病患者营养支持的合理计算方法。除恰当的食谱搭配外,必要时可行肠道内、外营养物质的补充,以期维持体重,增强肌力,克服膈肌疲劳。 6.康复治疗 目的在于使进行性气流受限、严重呼吸困难、活动受限的患者,改善活动能力,提高生活质量。包括: (1)呼吸生理治疗:鼓励和协助患者咳嗽、用力呼气,以促进痰液的排出;指导患者作缩唇呼气,增加气道内压力,以抵抗气道外的动力压迫,使等压点移向中央大气道,可防止气道于呼气时过早闭合。 (2)肌肉训练:全身性活动锻炼,包括步行、登楼、踏车等。呼吸肌锻炼,嘱患者作深而慢的腹式呼吸,使降低呼吸阻力,增加潮气量,减少无效腔通气,使气体分布均匀,和通气-血流比例失调得到改善。 7.其他 针对上述COPD的气道炎症机制,在治疗方面亦呈现一些新的动向和苗头,如使用黏附分子的单克隆抗体可抑制白细胞在血管内皮细胞上黏附和跨内皮转移,此有可能限制炎症反应的进程。应用IL-8、MIP-2单克隆抗体亦可抑制其对中性粒细胞的趋化效应,从而减缓炎症反应的发生与发展。此外,采用弹性蛋白酶抑制剂ONO-5046治疗COPD,可抑制中性粒细胞释放弹性蛋白酶,以达到减轻肺组织损伤的目的。然而,这些治疗目前大多仍处于实验阶段,将来可望成为治疗COPD有前途的处理措施。其他如非创伤性家庭机械通气,通过鼻罩或口鼻罩与呼吸机连接,在患者家中进行间断机械通气,可达到使呼吸肌休息,缓解膈肌疲劳和改善呼吸肌功能的目的。此外,适当注射人血丙种球蛋白,应用免疫增强剂或免疫调节剂对提高机体抵抗力,防止呼吸道感染亦具有一定的作用。 近年来国内外开展的肺减容术治疗阻塞性肺气肿,对于改善肺功能、提高患者生存率和改善生活质量方面均具有积极的意义。[收起]
目的在于阻止症状发展和疾病的反复加重;保持最适当的肺功能;改善活动能力,提高生活质量。具体措施如下。 1.停止吸烟 吸烟是引起阻塞性肺气肿的主要危险因素,停止吸烟是治疗的重要措施之一。众所周知,呼吸功能随年龄的增长而减退,在不吸烟的正常人群中,25~30岁以后,FEV1每年约下降25~30ml,吸烟者FEV1下降较不吸烟者明显,其下降的曲线陡直,以重度吸烟者更为显著。吸烟者中约10%~15%为COPD的易感者,在这些人群中FEV1的下降更为严重,每年下降约150ml,当其至60岁时FEV1平均仅0.8L,此时常感呼吸困难,难以胜任日常活动,已经达到致残的地步。然而,如能在50岁时戒...[详细]
阻塞性肺气肿为缓慢的通气功能进行性下降的自然病程,当FEV1下降至预计值的25%以下时,则可能发生呼吸衰竭。首次呼吸衰竭发生后的5年生存率仅15%~20%。一般估计FEV1>1.2L者可生存10年;FEVl为1.0L者,约生存5年;FEVl<0.7L者,生存期约2年。
着重预防慢性支气管炎患者发展为气流受限。包括宣传吸烟有害健康,已吸烟者应立即戒烟;避免有害粉尘、烟雾或气体的吸入,工厂、矿山应作好粉尘和有害气体的处理,如采用湿式作业,密闭尘源,加强通风和个人防护;预防呼吸道感染,包括病毒、支原体或细菌感染。可定期注射流感疫苗,肺炎球菌疫苗等对于预防易感者具有一定的意义;对慢性支气管炎患者定期监测肺通气功能(FEVl、FEVl/FVC及FEVl%),及早发现气流受限发生情况,并采取相应的防治措施;此外,提高患者的生活水平,增加营养,加强卫生健康教育,改善工作环境与条件,养成良好的卫生习惯等,对本病的防治均具有重要的意义。

 3.遗传因素 肺气肿的发生还与遗传因素有关。正常人血清中α1-AT是按常染色体隐性基因遗传的。在遗传过程中,正常人群绝大多数均由2个M型等位基因组成的纯合子,遗传表现型为PiMM,携带者的α1-AT血清浓度正常(>250mg/dl)。由2个Z型等位基因组成的纯合子,PiZZ为其表型,其血清α1-AT仅为正常人的10%~15%(<50mg/dl),携带该遗传表型者为数很少,白种人群中仅约1∶2000(0.05%~0.07%);此外,与α1-AT缺乏有关的纯合子,其遗传表型为PiSS。至于由两个不同等位基因组合者为杂合子,遗传表型以PiMZ较多(4%~4.7%),其次为PiMS(0.5%)和PiSZ(0.08%~0.14%),其余的杂合子表型则更常见。根据对3724名国人调查表明,α1-AT遗传表型主要仍为PiMM,未发现1例PiZZ纯合子,其他类型如PiSS以及PiMZ和PiSZ等肺气肿发生率亦不高。因此,遗传性α1-AT缺乏所致的肺气肿在我国并不重要。 4.病理改变 大体检查见肺过度膨胀,弹性减退,剖胸后肺脏不能回缩。外观灰白或苍白,表面可见多个大小不一的大泡。镜下见终末细支气管远端气囊腔膨胀,间隔变窄,弹力纤维变细或断裂。肺泡壁变薄,肺泡孔扩大,肺泡破裂或形成大泡。与细支气管伴行的肺小血管呈炎症改变,中膜平滑肌水肿、变性和坏死,管腔狭窄甚至闭塞。因肺泡破裂和炎症的侵蚀破坏,肺毛细血管床数量及横断面积均减少。肺气肿时细支气管的病理改变与慢性支气管炎相同。
3.遗传因素 肺气肿的发生还与遗传因素有关。正常人血清中α1-AT是按常染色体隐性基因遗传的。在遗传过程中,正常人群绝大多数均由2个M型等位基因组成的纯合子,遗传表现型为PiMM,携带者的α1-AT血清浓度正常(>250mg/dl)。由2个Z型等位基因组成的纯合子,PiZZ为其表型,其血清α1-AT仅为正常人的10%~15%(<50mg/dl),携带该遗传表型者为数很少,白种人群中仅约1∶2000(0.05%~0.07%);此外,与α1-AT缺乏有关的纯合子,其遗传表型为PiSS。至于由两个不同等位基因组合者为杂合子,遗传表型以PiMZ较多(4%~4.7%),其次为PiMS(0.5%)和PiSZ(0.08%~0.14%),其余的杂合子表型则更常见。根据对3724名国人调查表明,α1-AT遗传表型主要仍为PiMM,未发现1例PiZZ纯合子,其他类型如PiSS以及PiMZ和PiSZ等肺气肿发生率亦不高。因此,遗传性α1-AT缺乏所致的肺气肿在我国并不重要。 4.病理改变 大体检查见肺过度膨胀,弹性减退,剖胸后肺脏不能回缩。外观灰白或苍白,表面可见多个大小不一的大泡。镜下见终末细支气管远端气囊腔膨胀,间隔变窄,弹力纤维变细或断裂。肺泡壁变薄,肺泡孔扩大,肺泡破裂或形成大泡。与细支气管伴行的肺小血管呈炎症改变,中膜平滑肌水肿、变性和坏死,管腔狭窄甚至闭塞。因肺泡破裂和炎症的侵蚀破坏,肺毛细血管床数量及横断面积均减少。肺气肿时细支气管的病理改变与慢性支气管炎相同。 胸部的CT检查特别是薄层高分辨CT(HRCT)可确定小叶中央型或全小叶型肺气肿等病变,了解肺大泡的大小和数量,估计非大泡区域肺气肿的程度,对预计手术治疗效果有一定的意义。但不应作为常规检查。
胸部的CT检查特别是薄层高分辨CT(HRCT)可确定小叶中央型或全小叶型肺气肿等病变,了解肺大泡的大小和数量,估计非大泡区域肺气肿的程度,对预计手术治疗效果有一定的意义。但不应作为常规检查。

