-
科室:
小儿血液科
-
别名:
congenital aplastic anemia of children
小儿范可尼综合征
小儿凡科尼综合征
-
症状:
脱水
多饮
多尿
-
发病部位:
暂无
-
多发人群:
暂无
-
相关疾病:
贫血
范科尼综合征(Fanconi syndrome)的特点是骨髓造血功能衰竭,以多种肾小管功能紊乱为特征,导致贫血,氨基酸、葡萄糖、磷酸盐、碳酸氢盐和其他由近端或远端肾小管处的有机物或无机物从尿中丢失过多,因而出现酸中毒、低磷酸盐血症、低钙血症、脱水、佝偻病、骨质疏松、生长过缓等表现。Fanconi综合征(Fanconi syndrome)可分为先天性或获得性,原发性或继发性,完全性或不完全性几类。临床上较为罕见,起病缓慢,且多于青壮年出现症状,预后与治疗早晚和对治疗的反应有关。
幼儿大多与遗传有关,年长儿多继发于免疫性疾病、毒物或药物中毒以及各种肾脏病。 1.原发性(原因不明或无全身性疾病) 包括遗传性常染色体显性(AD)、常染色体隐性(AR)、X连锁隐性(XLR)、散发性、特殊型(即刷状缘缺失型)。 2.继发性(症状型) (1)先天性代谢障碍: ①氨基酸代谢障碍: A.胱氨酸病(常染色体隐性,AR)。 B.酪氨酸血症Ⅰ型(AR)。 C.Busby综合征(AR)。 D.Luder sheldon综合征(AD)。 ②碳水化合物代谢障碍: A.糖原贮积病Ⅰ型(Fanconi-Bickel综合征,AR)。 B.半乳糖血症(AR)。 C.遗传性果糖不耐受症(AR)。 ③其他: A.Lowe综合征(XLR)。 B.肝豆状核变性(AR)。 C.细胞色素C氧化酶缺陷(AR)。 D.Dent病(家族性近端肾小管疾病,XLR)。 E.Pearson综合征,Wilson病。 F.维生素B12缺乏。 (2)获得性疾病如:①多发性骨髓瘤;②肾病综合征;③肾移植;④肿瘤;⑤糖尿病;⑥急、慢性间质性肾炎;⑦急性肾小管坏死;⑧营养不良;⑨巴尔干肾病;⑩严重低钾血症。 (3)药物损伤及中毒如:①重金属(汞、钠、铅、镉);②化学毒剂马来酸、来苏儿、甲苯、甲酚、硝苯等;③过期四环素、丙酸;④顺铂、IFostamide、氨基糖苷类抗生素、维生素中毒;⑤雷米替丁、西米替丁、中草药如马兜铃肾损害等。[收起]
幼儿大多与遗传有关,年长儿多继发于免疫性疾病、毒物或药物中毒以及各种肾脏病。 1.原发性(原因不明或无全身性疾病) 包括遗传性常染色体显性(AD)、常染色体隐性(AR)、X连锁隐性(XLR)、散发性、特殊型(即刷状缘缺失型)。 2.继发性(症状型) (1)先天性代谢障碍: ①氨基酸代谢障碍: A.胱氨酸病(常染色体隐性,AR)。 B.酪氨酸血症Ⅰ型(AR)。 C.Busby综合征(AR)。 D.Luder sheldon综合征(AD)。 ②碳水化合物代谢障碍: A.糖原...[详细]
1.发病机制 本病发病机制尚未完全清楚,有以下几种可能: (1)内流缺陷:管腔内向组织内流减少,见于刷状缘缺失型。 (2)细胞内回漏到肾小管腔增加:如马来酸中毒型。 (3)回流减少:通过基底侧细胞膜回流减少,致细胞内物质堆积;影响回吸收,如Fanconi-Bickel综合征。 (4)灌注增加:从血液向细胞灌注增加,通过细胞紧密连结处反流管腔增加,如细胞色素C氧化酶缺乏型。肾小管膜的输送异常在病理组织学检查中未见特异性表现。有实验提示本征的细胞内ATP活性的转运功能不全是由于磷酸盐耗竭,引起细胞内腺嘌呤核苷酸降解,因而发生ATP消耗。本症的病理生理学改变见图1。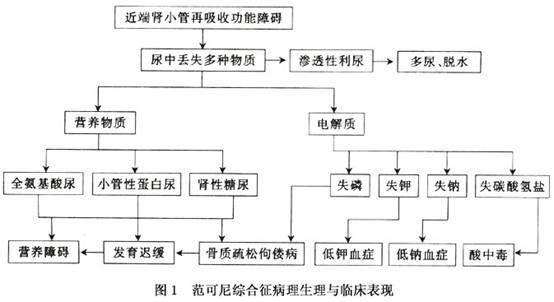 2.病理与病理生理 随着分子生物学的研究进展,已认识到FA的发生是一个复杂的病理生理过程,DNA损伤识别或修复缺陷是FA发生的关键,由于DNA的异常启动了相关的病理机制。 (1)DNA交联修复缺陷:FA细胞对能产生链内和链间交联的双功能交联剂(如DEB、MMC、氮芥、环磷酰胺、顺铂等)敏感。DEB和MMC诱导的链内交联修复使DNA链切开,双链DNA同时损伤则没有可用的模板进行修复,需通过非同源末端连接(NHEJ)修复。在FA细胞,非同源重组修复的保真性下降,导致细胞缺陷。相反,通过姊妹染色单体互换的同源重组在FA没有缺陷。除了NHEJ异常,DNA损伤的识别也是受损的,使FA细胞在复制完成以后阻滞在G2期检查点。 (2)FA细胞对氧的超敏性:一种理论认为,FA细胞是被蓄积的氧自由基损伤的,这些氧自由基是由以下诱变剂产生的,如:高氧张力、γ-射线、诱裂剂和产生活性氢氧根的药物。FA细胞红细胞过氧化物歧化酶(SOD)的水平降低,而白细胞SOD的浓度正常。也有红细胞SOD、过氧化氢酶和谷胱甘肽过氧化酶水平正常而谷胱甘肽转移酶水平上升的报道。在FA,成纤维细胞SOD的水平正常,Mn-SOD、过氧化氢酶和谷胱甘肽过氧化酶的浓度增加,因此有人提出氧化剂的作用可能限于造血系统。SOD或过氧化氢酶加入到FA的淋巴细胞培养中能减少断裂的数量,其他的研究者发现SOD、过氧化氢酶或半胱氨酸可减少MMC诱导的断裂。在高氧张力的情况下培养淋巴细胞导致一些FA细胞的任意断裂的数量增加,正常细胞和加入MMC后的所有FA细胞均没有增加。Clarke等研究了FA细胞的凋亡,显示在5%氧浓度时暴露在MMC中与正常细胞相同,当20%氧浓度时则对MMC超敏,暗示对FA细胞的毒性作用是MMC产生的氧反应产物(ROS)引起的,而不是DNA交联形成。FA的氧敏感性涉及控制ROS过度产生的复杂系统或耐受氧诱导损害的能力,除线粒体外,细胞内产生ROS很大程度上是由于细胞色素P450酶系统,有研究表明FANCC蛋白与NADPH细胞色素P450还原酶、FANCG蛋白与细胞色素P4502E1(CYP2E1)之间相互作用,这两种酶都产生R0S。低氧张力和抗氧化剂被用于改善生长和减少FA细胞任意或MMC诱导的染色体断裂。 (3)细胞周期调控异常:FA细胞生长缓慢,G2期延长。对类人猿病毒40(SV40)或腺病毒12的转换是敏感的并表达SV40T抗原。不管是任意的或诱变剂治疗后,FA细胞的姊妹染色单体互换一般不增加。在体外交联中FA细胞是低突变的,与正常细胞一样,主要的突变是缺失而不是点突变。FA细胞在细胞周期调控中有缺陷,G2/M期转换延迟,这进一步增加了交联剂或高氧浓度的暴露。G2/M检查点与基因组的监视和进入有丝分裂前的损伤修复有关,FA细胞存在同源性重组增加和非同源性终末连接缺陷,FA细胞不能有效的修复DNA损伤,因而停滞在G2期。G2期阻滞能被细胞周期蛋白家族中的一种SPHAR的过度表达以及咖啡因矫正,后者活化了周期依赖性激酶cdc2和废弃了一个G2的检查点。 (4)细胞凋亡和端粒维持:许多研究显示FA细胞凋亡调节异常,在一个研究中,4个FA淋巴细胞系加入MMC治疗导致了凋亡增加,但其他的研究显示FA细胞的自发凋亡增加,γ射线照射时凋亡减少,而加入MMC后凋亡没有变化。凋亡的增加可能与FA细胞修复损伤的能力有关,也可能在凋亡途径中,FA蛋白与其他蛋白相互作用的缺陷有关。FA细胞中可检测到端粒缩短加速,但在其他类型的AA和MDS中也存在。这[收起]
1.发病机制 本病发病机制尚未完全清楚,有以下几种可能: (1)内流缺陷:管腔内向组织内流减少,见于刷状缘缺失型。 (2)细胞内回漏到肾小管腔增加:如马来酸中毒型。 (3)回流减少:通过基底侧细胞膜回流减少,致细胞内物质堆积;影响回吸收,如Fanconi-Bickel综合征。 (4)灌注增加:从血液向细胞灌注增加,通过细胞紧密连结处反流管腔增加,如细胞色素C氧化酶缺乏型。肾小管膜的输送异常在病理组织学检查中未见特异性表现。有实验提示本征的细胞内ATP活性的转运功能不全是由于磷酸盐耗竭,引起细胞内腺嘌呤核苷酸降解,因而发生ATP消耗。本症的病理生...[详细]
2.病理与病理生理 随着分子生物学的研究进展,已认识到FA的发生是一个复杂的病理生理过程,DNA损伤识别或修复缺陷是FA发生的关键,由于DNA的异常启动了相关的病理机制。 (1)DNA交联修复缺陷:FA细胞对能产生链内和链间交联的双功能交联剂(如DEB、MMC、氮芥、环磷酰胺、顺铂等)敏感。DEB和MMC诱导的链内交联修复使DNA链切开,双链DNA同时损伤则没有可用的模板进行修复,需通过非同源末端连接(NHEJ)修复。在FA细胞,非同源重组修复的保真性下降,导致细胞缺陷。相反,通过姊妹染色单体互换的同源重组在FA没有缺陷。除了NHEJ异常,DNA损伤的识别也是受损的,使FA细胞在复制完成以后阻滞在G2期检查点。 (2)FA细胞对氧的超敏性:一种理论认为,FA细胞是被蓄积的氧自由基损伤的,这些氧自由基是由以下诱变剂产生的,如:高氧张力、γ-射线、诱裂剂和产生活性氢氧根的药物。FA细胞红细胞过氧化物歧化酶(SOD)的水平降低,而白细胞SOD的浓度正常。也有红细胞SOD、过氧化氢酶和谷胱甘肽过氧化酶水平正常而谷胱甘肽转移酶水平上升的报道。在FA,成纤维细胞SOD的水平正常,Mn-SOD、过氧化氢酶和谷胱甘肽过氧化酶的浓度增加,因此有人提出氧化剂的作用可能限于造血系统。SOD或过氧化氢酶加入到FA的淋巴细胞培养中能减少断裂的数量,其他的研究者发现SOD、过氧化氢酶或半胱氨酸可减少MMC诱导的断裂。在高氧张力的情况下培养淋巴细胞导致一些FA细胞的任意断裂的数量增加,正常细胞和加入MMC后的所有FA细胞均没有增加。Clarke等研究了FA细胞的凋亡,显示在5%氧浓度时暴露在MMC中与正常细胞相同,当20%氧浓度时则对MMC超敏,暗示对FA细胞的毒性作用是MMC产生的氧反应产物(ROS)引起的,而不是DNA交联形成。FA的氧敏感性涉及控制ROS过度产生的复杂系统或耐受氧诱导损害的能力,除线粒体外,细胞内产生ROS很大程度上是由于细胞色素P450酶系统,有研究表明FANCC蛋白与NADPH细胞色素P450还原酶、FANCG蛋白与细胞色素P4502E1(CYP2E1)之间相互作用,这两种酶都产生R0S。低氧张力和抗氧化剂被用于改善生长和减少FA细胞任意或MMC诱导的染色体断裂。 (3)细胞周期调控异常:FA细胞生长缓慢,G2期延长。对类人猿病毒40(SV40)或腺病毒12的转换是敏感的并表达SV40T抗原。不管是任意的或诱变剂治疗后,FA细胞的姊妹染色单体互换一般不增加。在体外交联中FA细胞是低突变的,与正常细胞一样,主要的突变是缺失而不是点突变。FA细胞在细胞周期调控中有缺陷,G2/M期转换延迟,这进一步增加了交联剂或高氧浓度的暴露。G2/M检查点与基因组的监视和进入有丝分裂前的损伤修复有关,FA细胞存在同源性重组增加和非同源性终末连接缺陷,FA细胞不能有效的修复DNA损伤,因而停滞在G2期。G2期阻滞能被细胞周期蛋白家族中的一种SPHAR的过度表达以及咖啡因矫正,后者活化了周期依赖性激酶cdc2和废弃了一个G2的检查点。 (4)细胞凋亡和端粒维持:许多研究显示FA细胞凋亡调节异常,在一个研究中,4个FA淋巴细胞系加入MMC治疗导致了凋亡增加,但其他的研究显示FA细胞的自发凋亡增加,γ射线照射时凋亡减少,而加入MMC后凋亡没有变化。凋亡的增加可能与FA细胞修复损伤的能力有关,也可能在凋亡途径中,FA蛋白与其他蛋白相互作用的缺陷有关。FA细胞中可检测到端粒缩短加速,但在其他类型的AA和MDS中也存在。这[收起]
1.发病机制 本病发病机制尚未完全清楚,有以下几种可能: (1)内流缺陷:管腔内向组织内流减少,见于刷状缘缺失型。 (2)细胞内回漏到肾小管腔增加:如马来酸中毒型。 (3)回流减少:通过基底侧细胞膜回流减少,致细胞内物质堆积;影响回吸收,如Fanconi-Bickel综合征。 (4)灌注增加:从血液向细胞灌注增加,通过细胞紧密连结处反流管腔增加,如细胞色素C氧化酶缺乏型。肾小管膜的输送异常在病理组织学检查中未见特异性表现。有实验提示本征的细胞内ATP活性的转运功能不全是由于磷酸盐耗竭,引起细胞内腺嘌呤核苷酸降解,因而发生ATP消耗。本症的病理生...[详细]
1.原发性Fanconi综合征 是一种常染色体隐性遗传疾病,诊断时的平均年龄男性是6.5岁,女性是8岁。发病年龄范围从出生到48岁。男女比例1.2∶1。发病无种族或地区差异,一家中可有兄弟姐妹多人发病。早期患者的诊断是在再生障碍性贫血(白血病或肿瘤)发生时做出的;最近认为,患者的同胞有阳性的染色体断裂或有特征性躯体异常,就诊者即使没有贫血也可以做出FA的诊断。FA为一综合征,临床表现主要包括3方面:骨髓衰竭、各种发育异常和肿瘤易感性增加。 (1)Alter分型:根据血液学特点,Alter等于1991年把FA分为6个临床亚型: ①重型再生障碍性贫血,依赖输血,雄激素无效或未接受雄激素治疗。 ②重型再生障碍性贫血,依赖输血,正接受雄激素治疗,但疗效不佳。 ③中、重度再生障碍性贫血,不依赖输血,雄激素治疗有效。 ④中、重度再生障碍性贫血,不依赖输血,未接受雄激素治疗或雄激素治疗无效。 ⑤有骨髓衰竭的特征,如轻度贫血、粒细胞减少、血小板减少;大红细胞,HbF增高。病情稳定,不需输血和雄激素治疗。 ⑥血象正常,HbF正常或轻度异常,不需输血和雄激素治疗。 (2)表现特点:本病临床表现取决于肾小管功能障碍的类型和程度。全氨基酸尿、糖尿以及高磷酸盐尿导致低磷血症为本症的三大特征,但不完全性Fanconi综合征不是全部具备上述3个特征,往往只具备其中1、2项。 ①婴儿型:也称急性型,特点有: A.起病早,6~12个月发病。 B.常因烦渴、多饮、多尿、脱水、消瘦、呕吐、便秘、无力而就诊。 C.生长迟缓、发育障碍,出现抗维生素D佝偻病及营养不良、骨质疏松甚至骨折等表现。 D.肾性全氨基酸尿,但血浆氨基酸正常。 E.低血钾,低血磷,碱性酸酶活性增高,高氯血症性代谢性酸中毒,尿中可滴定酸及NH4可减少,尿糖微量或增多,血糖正常。 F.预后较差,可死于尿毒症性酸中毒或继发感染。 ②幼儿型:起病较晚(2岁以后),症状较婴儿型轻,以抗维生素D佝偻病及生长迟缓为最突出表现。 ③成人型:特点有: A.10~20岁或更晚发病。 B.多种肾小管功能障碍;如糖尿、全氨基酸尿、高磷酸盐尿、低血钾、高氯酸中毒。 C.软骨病往往是突出表现。 D.晚期可出现肾功能衰竭。 (3)血液学异常: FA最重要的临床特征是血液学异常,FA是遗传性骨髓衰竭综合征最常见的类型,AA、MDS和AML在纯合子的发生率都显著增加。患者出生时的血细胞计数是正常的,最早被检测到的异常是大红细胞症,随后出现血小板减少和中性粒细胞减少。40岁以前出现血液学异常的概率是98%,最常见的血液学异常是血小板减少和全血细胞减少,与骨髓增生低下有关。53%的患者以全血细胞减少发病,38%的患者以血小板减少发病,随访20年后有84%的患者发展为全血细胞减少,少部分患者以贫血、中性粒细胞减少发病,部分患者发病时即为骨髓增生异常综合征(MDS)或急性白血病(尤其是急性髓系白血病)。临床上,FA患者有出血、苍白和(或)反复感染。 (4)其他表现:身材矮小的FA患者28例检测了生长激素(GH)水平,有22例GH缺乏,GH激素治疗15例患者有12例长高,无一例患者造血改善,GH治疗的患者中一例死于急性髓系白血病。最近报道44%的患者有GH缺乏,36%的患者有甲状腺功能减低。重组GH在生长和造血中的作用还需要进一步观察,而且GH治疗和白血病之间的可能联系需要仔细探讨。 2.继发性Fanconi综合征 因病因不同,表现有所不同。[收起]
1.原发性Fanconi综合征 是一种常染色体隐性遗传疾病,诊断时的平均年龄男性是6.5岁,女性是8岁。发病年龄范围从出生到48岁。男女比例1.2∶1。发病无种族或地区差异,一家中可有兄弟姐妹多人发病。早期患者的诊断是在再生障碍性贫血(白血病或肿瘤)发生时做出的;最近认为,患者的同胞有阳性的染色体断裂或有特征性躯体异常,就诊者即使没有贫血也可以做出FA的诊断。FA为一综合征,临床表现主要包括3方面:骨髓衰竭、各种发育异常和肿瘤易感性增加。 (1)Alter分型:根据血液学特点,Alter等于1991年把FA分为6个临床亚型: ①重型再生障碍性贫血,依赖输血,雄激素无效...[详细]
1.并发症 常并发发育障碍、抗维生素D佝偻病及营养不良、骨质疏松甚至骨折、低血钾、低血磷、高氯血症,死于尿毒症性酸中毒或继发感染。 2.多伴发先天性畸形 在婴儿期诊断的FA患者有较高的比例有特征性躯体异常,如畸形包括拇指和桡骨、肾脏、头、眼睛和耳朵以及胃肠道畸形。相反,在年长儿诊断的FA患者,躯体异常少见。身材矮小和皮肤色素问题随着年龄增加而显现出来。FA患者的典型异常包括:身材矮小,拇指或桡骨不发育或缺如或多指,小眼球,小头畸形,皮肤色素沉着、浅褐色斑和色素脱失斑。以及特征性面部表现如鼻基底部增宽,眦上皱襞和小颌。大约1/3的患者有肾脏异常,包括肾发育不全,马蹄形肾或双输尿管。生殖系统发育不全(女性月经来潮较晚,月经不规则,绝经早,妇科肿瘤多;男性性腺、尿道发育不完全)。少见的异常包括胃肠道、心脏和中枢神经系统等部位的缺陷。只有血象和骨髓象异常的而无先天畸形的患者称为Estren-Dameshek综合征,这些患者仅代表FA范畴中的一部分。IFAR(International Fanconi Anemia Registry)分析的370例患者中几乎40%躯体检查正常,这些发现提示骨髓衰竭的患者仔细检查遗传学异常的重要性。 3.肿瘤易感性 FA患者发生白血病和肿瘤的报道多于200例,总的发生率大于15%。急性白血病占100例以上,占FA患者的10%,主要是急性髓系白血病。发生MDS的危险是10%~35%。有克隆性细胞遗传学异常的患者发生MDS或AML的危险明显高于染色体核型正常者。克隆性细胞遗传学异常累及染色体1和7,其他的异常包括染色体部分或完全的缺失、易位和标记染色体。FA患者发生实体瘤的危险性随年龄的增大而增加,大多数是鳞状细胞癌,最常累及消化道和女性生殖系统。 4.FA异质性 在FA患者的亲戚中可发现先天性畸形、泌尿生殖系统和手的特殊异常。一些FA患者的父母亲有身体畸形如身材矮小,但没有血液学疾病。Pefidou和Barrett注意到有关的异质性有HbF水平的增加,自然杀伤细胞数量的减少和对丝裂霉素反应差。FA的异质性也可以通过染色体断裂分析被检测。[收起]
1.并发症 常并发发育障碍、抗维生素D佝偻病及营养不良、骨质疏松甚至骨折、低血钾、低血磷、高氯血症,死于尿毒症性酸中毒或继发感染。 2.多伴发先天性畸形 在婴儿期诊断的FA患者有较高的比例有特征性躯体异常,如畸形包括拇指和桡骨、肾脏、头、眼睛和耳朵以及胃肠道畸形。相反,在年长儿诊断的FA患者,躯体异常少见。身材矮小和皮肤色素问题随着年龄增加而显现出来。FA患者的典型异常包括:身材矮小,拇指或桡骨不发育或缺如或多指,小眼球,小头畸形,皮肤色素沉着、浅褐色斑和色素脱失斑。以及特征性面部表现如鼻基底部增宽,眦上皱襞和小颌。大约1/3的患者有肾脏异常,包括肾发育不全,马蹄形肾或双输尿管...[详细]
1.血象 血常规检查显示三系呈不同程度下降,贫血属正细胞正色素性。大红细胞伴有轻度的异形性和红细胞大小不均,网织红细胞减少,但有时可高达3%,白细胞和中性粒细胞比例下降,血小板下降最早。 一些患者红细胞寿命缩短,胎儿血红蛋白(HbF)水平增高达3%~15%。 2.骨髓象 骨髓象类似于获得性再障。当发生再障时,FA患者的骨髓增生低下和脂肪化,造血成分减少,红系和粒系比例下降,有时可出现红细胞巨幼样变。巨核细胞明显减少,淋巴细胞、组织嗜碱细胞、网状细胞等非造血细胞的数量相对增多。 3.激素水平 身材矮小的FA患者28例检测了生长激素(GH)水平,有22例GH缺乏,GH激素治疗15例患者有12例长高,无一例患者造血改善,GH治疗的患者中一例死于急性髓系白血病。最近报道44%的患者有GH缺乏,36%的患者有甲状腺功能减低。重组GH在生长和造血中的作用还需要进一步观察,而且GH治疗和白血病之间的可能联系需要仔细探讨。 4.诊断性实验室检查 诊断性检查是染色体断裂。用植物血凝素刺激培养的外周血的淋巴细胞,FA患者的细胞断裂、裂隙、重排、互换和核内复制的比例高。当加入诱裂剂如DEB或MMC时,这些染色体异常则显著地增加。FA纯合子的外周血淋巴细胞加DEB培养后每个细胞平均有8.96个断裂,正常细胞平均有0.06个断裂。另外诊断FA的方法是流式细胞仪。FA患者细胞生长缓慢是由于细胞周期的G2期延长,用烷化剂治疗的细胞不能分裂,但有染色体复制和在G2期的蓄积,由于含有DNA的量增加因此能被检测。 5.其他 半数病人出现氨基酸尿,以脯氨酸尿为多见。红细胞生成素的水平在FA患者增加。红细胞长期存在i抗原(正常人2岁前消失)。[收起]
1.血象 血常规检查显示三系呈不同程度下降,贫血属正细胞正色素性。大红细胞伴有轻度的异形性和红细胞大小不均,网织红细胞减少,但有时可高达3%,白细胞和中性粒细胞比例下降,血小板下降最早。 一些患者红细胞寿命缩短,胎儿血红蛋白(HbF)水平增高达3%~15%。 2.骨髓象 骨髓象类似于获得性再障。当发生再障时,FA患者的骨髓增生低下和脂肪化,造血成分减少,红系和粒系比例下降,有时可出现红细胞巨幼样变。巨核细胞明显减少,淋巴细胞、组织嗜碱细胞、网状细胞等非造血细胞的数量相对增多。 3.激素水平 身材矮小的FA患者28例检测了生长激素(GH)水平,有22例G...[详细]
X线检查,包括胸片和骨片检查;B超或超声心动图检查等各种影像学检查,根据临床需要选择。X线检查可发现骨质疏松、佝偻病表现;胱氨酸储积病者,眼裂隙灯检查可见角膜有胱氨酸结晶沉着等。
本病根据再生障碍性贫血,生长迟缓、佝偻病、多尿及脱水、酸中毒、电解质紊乱等相应的临床表现;血生化检查见低血钾、低血磷、低血钠、低血氯性酸中毒、高AKP、低血尿酸、糖尿而血糖正常,全氨基酸尿、尿pH低而尿氨和可滴定酸低;X线检查有骨质疏松、佝偻病表现,均有助于诊断,注意询问家族史。应注意原发病的诊断,如胱氨酸储积病者,眼裂隙灯检查可见角膜有胱氨酸结晶沉着,骨髓或血白细胞中胱氨酸含量增加并见到胱氨酸结晶,对本病确切诊断十分重要。由于多种类型Fanconi综合征可通过特异性治疗及对症处理取得良好疗效,因此病因诊断尤为重要。
1.病因治疗 对代谢缺陷类型已被认识的继发性Fanconi综合征,可进行特异性治疗。通过饮食疗法减少或避免有毒代谢产物积聚的疾病有半乳糖血症、遗传性果糖不耐受、酪氨酸血症Ⅰ型。通过促进排泄治疗的疾病有Wilson病和重金属中毒。由药物引起的Fanconi综合征,清除体内药物可纠正肾小管功能障碍。坚持、恰当地进行特异性治疗,可使患者完全恢复正常。对于由肾脏疾病或全身疾病后引起的Fanconi综合征则相应针对原发病治疗。 2.对症治疗 (1)纠正酸中毒根据肾小管受损的程度给予碱性药物,剂量2~10mmol/(kg·d),可采用碳酸氢钠或者枸橼酸钠钾合剂,全天剂量分4~5次口服,然后根据血中HCO3- 浓度调整剂量。应注意同时补钾,如碱性药物用量过大,可合用氢氯噻嗪,促进HCO3-回吸收。 (2)纠正低磷血症:口服中性磷酸盐以纠正低磷血症,剂量为1~3g/d,分次服,每4~5小时用药1次,不良反应有胃肠不适和腹泻,减少用量可减轻上述症状。在部分患者,应用磷酸盐可加重低钙血症,诱发甲状旁腺功能亢进,可口服钙剂和维生素D预防。中性磷酸盐配方:Na2HPO4·7H2O 145g,Na2HPO4·H2O 18.2g,加水至1000ml,每1000ml供磷2g。 (3)其他:应补充血容量,防脱水,纠正低钾血症。对于低尿酸血症、氨基酸尿、糖尿及蛋白尿,目前尚缺乏有效的治疗方法。肾功能不全者,则酌情采用保守式肾脏替代治疗。 FA的治疗主要针对其血液学改变以及危及生命的各种并发症。 3.雄激素和皮质类固醇激素治疗 当FA患者发生全血细胞减少时,治疗主要是雄激素和支持治疗。雄激素可增加EPO的产生,刺激红系干细胞,从而提高血红蛋白水平。约75%的患者雄激素治疗有效,雄激素起效最早的表现是出现大红细胞以及HbF水平增加,开始治疗后2~3个月血红蛋白开始上升,随后血小板计数上升,最后中性粒细胞上升,要确定雄激素是否有效至少要坚持用药6个月以上。有效时间可持续几个月至20年不等。几乎所有的患者停用雄激素后复发,仅少数治疗时小于12岁的患者,在青春期时可停止治疗而不复发。最终许多患者对所用的雄激素耐药,换用另外一种雄激素少部分患者可能有效。由于雄激素的应用,延长了患者的生存期,但一些患者可能出现肿瘤等晚期并发症。 单独应用雄激素与雄激素加皮质类固醇激素的疗效相同,但一般推荐联合治疗,皮质类固醇激素引起的生长迟缓可抵消雄激素使生长加速的副作用,也可以通过降低血管的通透性减少出血。最常用的雄激素是司坦唑(康力龙),口服0.1mg/(kg·d),泼尼松(强的松)5~10mg,隔天1次。为降低肝脏毒性可用雄激素注射剂,苯丙酸诺龙(长效多乐宝灵)1~2mg/(kg·周),肌内注射,为预防血肿,可用冰袋冷敷和按压。 雄激素的副作用有女性男性化,多毛症以及声音变粗,外生殖器肥大,痤疮,情绪不稳,水、钠潴留,体重增加,肌肉发达,由于骨骼成熟加速致骨骺过早融合,最终导致身材矮小。这些副作用中部分在雄激素减量或停用后消失。比较严重的副作用包括肝大、胆汁郁积性黄疸和肝功能中转氨酶水平上升,但这些是可逆的。最严重的问题是肝紫癜、肝腺瘤和肝细胞癌,但这些在雄激素治疗停止后也能恢复。接受雄激素治疗的患者需定期进行肝生化检查和超声检查,治疗有效的患者可逐渐减量但不能停药。但有些患者雄激素可停用,这些患者可能有血液系统镶嵌现象,其“正常”干细胞有选择性造血优势。 4.细胞因子 造血生长因子如非格司亭(G-CSF)和莫拉司亭(GM-CSF)、能改善造血,特别是中性粒细胞减少的患者,能增加中性粒细胞绝对值,仅少数患者血红蛋白和血小板计数增加。可与雄激素联合应用或用于雄激素治疗无效的患者。然而,这些因子的应用也能使肿瘤易感的患者发生白血病或促使向MDS或7号染色体单体演化,因此仅用于严重中性粒细胞减少的患者,慎用于有克隆性细胞遗传学异常的患者,并注意监测外周血细胞计数,定期行骨髓检查和骨髓细胞遗传学检查,一旦发现异常应停用。 5.造血干细胞移植 造血干细胞移植是惟一能治愈FA患者的措施,也可以预防白血病的发生。HLA相合的同胞供者异基因骨髓移植,两年生存率可达到66%;无HLA相合的同胞供者可选择HLA相合的无关供者或不匹配的家族成员,但移植效果很差,两年生存率仅29%。HLA相合的同胞脐带血移植已有成功的报道,但需行着床胚胎遗传学诊断,以确定胚胎无FA倾向且与患者HLA相合。为获得HLA相合的同胞脐带血,需多次尝试,造成了大量的无FA倾向但HLA不相合的胚胎的浪费,这在伦理学上是有争议的。无关脐带血移植效果差。 由于FA患者对放疗和预处理方案药物如FAC[收起]
1.病因治疗 对代谢缺陷类型已被认识的继发性Fanconi综合征,可进行特异性治疗。通过饮食疗法减少或避免有毒代谢产物积聚的疾病有半乳糖血症、遗传性果糖不耐受、酪氨酸血症Ⅰ型。通过促进排泄治疗的疾病有Wilson病和重金属中毒。由药物引起的Fanconi综合征,清除体内药物可纠正肾小管功能障碍。坚持、恰当地进行特异性治疗,可使患者完全恢复正常。对于由肾脏疾病或全身疾病后引起的Fanconi综合征则相应针对原发病治疗。 2.对症治疗 (1)纠正酸中毒根据肾小管受损的程度给予碱性药物,剂量2~10mmol/(kg·d),可采用碳酸氢钠或者枸橼酸钠钾合剂,全天剂量分4~...[详细]
本病预后取决于所累及的脏器以及治疗开始的早晚、持续性和原发病等因素,严重患者最终多死于严重水、电解质紊乱及肾功能衰竭。
本症病因不明,可能系胚胎期受病毒感染和理化因素等外界致病因素影响而造成遗传基因变异和染色体异常,导致骨髓造血干细胞损伤和其他先天畸形。同此,应重视孕期保健,积极防治各种感染,尤其是病毒感染性疾病,避免理化因素、毒性物质的损害。

 2.病理与病理生理 随着分子生物学的研究进展,已认识到FA的发生是一个复杂的病理生理过程,DNA损伤识别或修复缺陷是FA发生的关键,由于DNA的异常启动了相关的病理机制。 (1)DNA交联修复缺陷:FA细胞对能产生链内和链间交联的双功能交联剂(如DEB、MMC、氮芥、环磷酰胺、顺铂等)敏感。DEB和MMC诱导的链内交联修复使DNA链切开,双链DNA同时损伤则没有可用的模板进行修复,需通过非同源末端连接(NHEJ)修复。在FA细胞,非同源重组修复的保真性下降,导致细胞缺陷。相反,通过姊妹染色单体互换的同源重组在FA没有缺陷。除了NHEJ异常,DNA损伤的识别也是受损的,使FA细胞在复制完成以后阻滞在G2期检查点。 (2)FA细胞对氧的超敏性:一种理论认为,FA细胞是被蓄积的氧自由基损伤的,这些氧自由基是由以下诱变剂产生的,如:高氧张力、γ-射线、诱裂剂和产生活性氢氧根的药物。FA细胞红细胞过氧化物歧化酶(SOD)的水平降低,而白细胞SOD的浓度正常。也有红细胞SOD、过氧化氢酶和谷胱甘肽过氧化酶水平正常而谷胱甘肽转移酶水平上升的报道。在FA,成纤维细胞SOD的水平正常,Mn-SOD、过氧化氢酶和谷胱甘肽过氧化酶的浓度增加,因此有人提出氧化剂的作用可能限于造血系统。SOD或过氧化氢酶加入到FA的淋巴细胞培养中能减少断裂的数量,其他的研究者发现SOD、过氧化氢酶或半胱氨酸可减少MMC诱导的断裂。在高氧张力的情况下培养淋巴细胞导致一些FA细胞的任意断裂的数量增加,正常细胞和加入MMC后的所有FA细胞均没有增加。Clarke等研究了FA细胞的凋亡,显示在5%氧浓度时暴露在MMC中与正常细胞相同,当20%氧浓度时则对MMC超敏,暗示对FA细胞的毒性作用是MMC产生的氧反应产物(ROS)引起的,而不是DNA交联形成。FA的氧敏感性涉及控制ROS过度产生的复杂系统或耐受氧诱导损害的能力,除线粒体外,细胞内产生ROS很大程度上是由于细胞色素P450酶系统,有研究表明FANCC蛋白与NADPH细胞色素P450还原酶、FANCG蛋白与细胞色素P4502E1(CYP2E1)之间相互作用,这两种酶都产生R0S。低氧张力和抗氧化剂被用于改善生长和减少FA细胞任意或MMC诱导的染色体断裂。 (3)细胞周期调控异常:FA细胞生长缓慢,G2期延长。对类人猿病毒40(SV40)或腺病毒12的转换是敏感的并表达SV40T抗原。不管是任意的或诱变剂治疗后,FA细胞的姊妹染色单体互换一般不增加。在体外交联中FA细胞是低突变的,与正常细胞一样,主要的突变是缺失而不是点突变。FA细胞在细胞周期调控中有缺陷,G2/M期转换延迟,这进一步增加了交联剂或高氧浓度的暴露。G2/M检查点与基因组的监视和进入有丝分裂前的损伤修复有关,FA细胞存在同源性重组增加和非同源性终末连接缺陷,FA细胞不能有效的修复DNA损伤,因而停滞在G2期。G2期阻滞能被细胞周期蛋白家族中的一种SPHAR的过度表达以及咖啡因矫正,后者活化了周期依赖性激酶cdc2和废弃了一个G2的检查点。 (4)细胞凋亡和端粒维持:许多研究显示FA细胞凋亡调节异常,在一个研究中,4个FA淋巴细胞系加入MMC治疗导致了凋亡增加,但其他的研究显示FA细胞的自发凋亡增加,γ射线照射时凋亡减少,而加入MMC后凋亡没有变化。凋亡的增加可能与FA细胞修复损伤的能力有关,也可能在凋亡途径中,FA蛋白与其他蛋白相互作用的缺陷有关。FA细胞中可检测到端粒缩短加速,但在其他类型的AA和MDS中也存在。这
2.病理与病理生理 随着分子生物学的研究进展,已认识到FA的发生是一个复杂的病理生理过程,DNA损伤识别或修复缺陷是FA发生的关键,由于DNA的异常启动了相关的病理机制。 (1)DNA交联修复缺陷:FA细胞对能产生链内和链间交联的双功能交联剂(如DEB、MMC、氮芥、环磷酰胺、顺铂等)敏感。DEB和MMC诱导的链内交联修复使DNA链切开,双链DNA同时损伤则没有可用的模板进行修复,需通过非同源末端连接(NHEJ)修复。在FA细胞,非同源重组修复的保真性下降,导致细胞缺陷。相反,通过姊妹染色单体互换的同源重组在FA没有缺陷。除了NHEJ异常,DNA损伤的识别也是受损的,使FA细胞在复制完成以后阻滞在G2期检查点。 (2)FA细胞对氧的超敏性:一种理论认为,FA细胞是被蓄积的氧自由基损伤的,这些氧自由基是由以下诱变剂产生的,如:高氧张力、γ-射线、诱裂剂和产生活性氢氧根的药物。FA细胞红细胞过氧化物歧化酶(SOD)的水平降低,而白细胞SOD的浓度正常。也有红细胞SOD、过氧化氢酶和谷胱甘肽过氧化酶水平正常而谷胱甘肽转移酶水平上升的报道。在FA,成纤维细胞SOD的水平正常,Mn-SOD、过氧化氢酶和谷胱甘肽过氧化酶的浓度增加,因此有人提出氧化剂的作用可能限于造血系统。SOD或过氧化氢酶加入到FA的淋巴细胞培养中能减少断裂的数量,其他的研究者发现SOD、过氧化氢酶或半胱氨酸可减少MMC诱导的断裂。在高氧张力的情况下培养淋巴细胞导致一些FA细胞的任意断裂的数量增加,正常细胞和加入MMC后的所有FA细胞均没有增加。Clarke等研究了FA细胞的凋亡,显示在5%氧浓度时暴露在MMC中与正常细胞相同,当20%氧浓度时则对MMC超敏,暗示对FA细胞的毒性作用是MMC产生的氧反应产物(ROS)引起的,而不是DNA交联形成。FA的氧敏感性涉及控制ROS过度产生的复杂系统或耐受氧诱导损害的能力,除线粒体外,细胞内产生ROS很大程度上是由于细胞色素P450酶系统,有研究表明FANCC蛋白与NADPH细胞色素P450还原酶、FANCG蛋白与细胞色素P4502E1(CYP2E1)之间相互作用,这两种酶都产生R0S。低氧张力和抗氧化剂被用于改善生长和减少FA细胞任意或MMC诱导的染色体断裂。 (3)细胞周期调控异常:FA细胞生长缓慢,G2期延长。对类人猿病毒40(SV40)或腺病毒12的转换是敏感的并表达SV40T抗原。不管是任意的或诱变剂治疗后,FA细胞的姊妹染色单体互换一般不增加。在体外交联中FA细胞是低突变的,与正常细胞一样,主要的突变是缺失而不是点突变。FA细胞在细胞周期调控中有缺陷,G2/M期转换延迟,这进一步增加了交联剂或高氧浓度的暴露。G2/M检查点与基因组的监视和进入有丝分裂前的损伤修复有关,FA细胞存在同源性重组增加和非同源性终末连接缺陷,FA细胞不能有效的修复DNA损伤,因而停滞在G2期。G2期阻滞能被细胞周期蛋白家族中的一种SPHAR的过度表达以及咖啡因矫正,后者活化了周期依赖性激酶cdc2和废弃了一个G2的检查点。 (4)细胞凋亡和端粒维持:许多研究显示FA细胞凋亡调节异常,在一个研究中,4个FA淋巴细胞系加入MMC治疗导致了凋亡增加,但其他的研究显示FA细胞的自发凋亡增加,γ射线照射时凋亡减少,而加入MMC后凋亡没有变化。凋亡的增加可能与FA细胞修复损伤的能力有关,也可能在凋亡途径中,FA蛋白与其他蛋白相互作用的缺陷有关。FA细胞中可检测到端粒缩短加速,但在其他类型的AA和MDS中也存在。这

